
| A. | 氧元素位于第2周期VIA族 | |
| B. | 元素周期表中有7个主族、7个副族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 |
分析 A.O的原子结构中有2个电子层、最外层电子数为6;
B.元素周期表有18个纵行,16个族;
C.He的最外层电子数为2;
D.位于金属与非金属交界处的元素可作半导体材料.
解答 解:A.O的原子结构中有2个电子层、最外层电子数为6,则氧元素位于第2周期VIA族,故A正确;
B.元素周期表有18个纵行,16个族,则元素周期表中有7个主族、7个副族、1个0族,1个第ⅤⅢ族(8、9、10三个纵行),故B正确;
C.He的最外层电子数为2,其它稀有气体元素原子的最外层电子数均为8,故C错误;
D.位于金属与非金属交界处的元素可作半导体材料,则铷、氯、锗三种元素中,适合作半导体材料的是锗,故D正确;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、原子结构、周期表的结构及应用等为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 | |
| B. | 除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 | |
| C. | CH4和CCl4中的化学键均为非极性键,CH4、CCl4都是正四面体结构 | |
| D. | 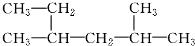 系统命名法为:2,4-二甲基-己烷 系统命名法为:2,4-二甲基-己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量相等 | B. | 失去电子的物质的量相等 | ||
| C. | 质量比为24:27:26 | D. | 质量比为12:18:28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
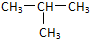 C.12C和13C
C.12C和13C 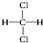 和
和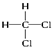
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化还原反应 | |
| D. | 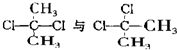 关系为同分异构体 关系为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们常用的元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 元素周期表中同一横行元素原子的电子层数相同 | |
| C. | 元素周期表有16个纵行 | |
| D. | 元素周期表已发展成一个稳定的形式,它不可能再有新的变化了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
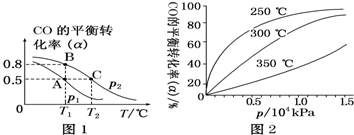 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.
煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:实验题
若用12 mol•L-1的浓盐酸配制0.10 mol•L-1的稀盐酸480 mL,回答下列问题:
(1)量取浓盐酸的体积为 mL,如果实验室有5mL、10mL、50mL量筒,应选用 mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为 mL 。
(3)配制时所需仪器除了容量瓶和量筒外,还需要的仪器有: 。
(4) 配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是 。
(5)若实验遇下列情况,所配溶液的浓度会有什么影响(填“偏高”,“偏低”或“无影响”)
A.溶解后没有冷却便进行定容________________ |
B.最后定容时,俯视观察液面与容量瓶刻度线________________ |
C.容量瓶内壁附有水珠而未干燥处理_______________ |
D.用量筒量取所需浓盐酸体积时俯视观察 。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com