
| A. | 增大亚硫酸钠粉末的量 | |
| B. | 硫酸浓度增大一倍,用量减少到原来的$\frac{1}{2}$ | |
| C. | 硫酸浓度不变,用量增大一倍 | |
| D. | 使反应在较低温度下进行 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
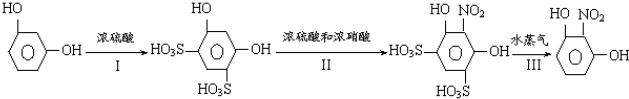

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ Na+ SO42- NO3- | B. | K+、Na+、Cl-、SO42-、 | ||
| C. | Ag+ K+ Ba2+ NO3- | D. | Mg2+ Ca2+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,X的A2B2型化合物的结构式是H-O-O-H.
,X的A2B2型化合物的结构式是H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.
100℃时,在容积为2.0L的恒容密闭容器中,通入乙烯和氧气,其中乙烯和氧气物质的量之比为2:1,发生反应:2C2H4 (g)+O2(g)?2CH3CHO(g)△H<0,体系中部分物质的物质的量随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28Si、29Si、30Si是同素异形体 | |
| B. | 自然界里存在大量的单质硅、二氧化硅和硅酸盐 | |
| C. | 硅和锗都是重要的半导体材料 | |
| D. | 二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 决定反应速率的主要因素是反应物的浓度 | |
| B. | 化学反应速率为0.8 mol/(L•s) 是指1s 时某物质的浓度为0.8mol/L | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 如图表示密闭容器中673 K,30 MPa下的反应:N2(g)+3H2(g)?2NH3(g)△H<0,n(NH3)和n(H2)随时间变化的关系曲线图.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2BC3 | B. | ABC3 | C. | ABC4 | D. | ABC |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com