
已知某溶液中存在较多的H+、SO 、NO
、NO ,则该溶液中还可能大量存在的离子组是( )
,则该溶液中还可能大量存在的离子组是( )
A.Al3+、CH3COO-、Cl- B.Na+、NH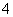 、Cl-
、Cl-
C.Mg2+、Cl-、Ag+ D.Mg2+、Ba2+、Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列所作出的结论中一定正确的是( )
A.无色试液使红色石蕊试纸变蓝,结论:该试液一定是碱溶液
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO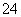
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中含氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH与Na2CO3·nH2O的混合物共28 g配制成100 mL溶液,测得该溶液中c(Na+)=4 mol/L。另取相同质量的上述混合物,加入足量的盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,试计算:
(1)原混合物中NaOH的质量分数。
(2)Na2CO3·nH2O中n值。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Na+的中性溶液中,还可能存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种,进行如下实验:
(1)原溶液滴加足量氯水后,有气泡生成,溶液呈橙黄色;
(2)向橙黄色溶液中加BaCl2溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉变蓝。
由此推断原溶液中一定不存在的离子是( )
A.NH4+、Br-、CO32- B.NH4+、I-、SO42-
C.Fe2+、I-、CO32- D.Fe2+、I-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH |
| 阴离子 | OH-、NO |
(1)若A、B的水溶 液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
①B的化学式为__________________________________________________________。
②A、B溶液混合加热反应的离子方程式_____________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为__________________________________________________________。
②经分 析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ________________________________________________________________________;
Ⅱ________________________________________________________________________。
③请用一简易方法证明上述溶液变黄的原因___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.( NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是 ( )。
A.碳酸钠的水解:CO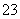 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-
B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH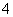
C.用惰性电极电解氯化镁溶液:2Cl-+2H+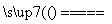 H2↑+Cl2↑
H2↑+Cl2↑
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
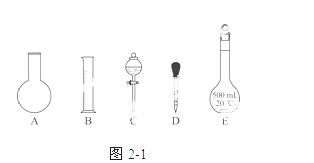
①如图21所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
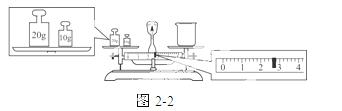
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图22。由图中可以看出,烧杯的实际质量为________g。
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是
_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com