

分析 (1)仪器a为滴液漏斗,仪器b为球形冷凝管;
(2)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气;
(3)二茂铁乙醚溶液的密度比水小,且不与水互溶,下层液从分液漏斗下口放出,上层液生成分液漏斗上口倒出;
(4)过滤二茂铁固体,防止逸散到空气中;
(5)可以通过测定所得固体的熔点确定;
(6)根据分子中不同H原子种类进行确定.
解答 解:(1)根据仪器的结构可知,仪器a为滴液漏斗,仪器b为球形冷凝管,
故答案为:滴液漏斗;球形冷凝管;
(2)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气,防止实验过程中亚铁离子被氧化,
故答案为:排尽装置中空气,防止实验过程中亚铁离子被氧化;
(3)二茂铁乙醚溶液的密度比水小,且不与水互溶,先将水层从分液漏斗的下口放出,为防止产生杂质,再将二茂铁乙醚溶液从上口倒出,故选:D;
(4)升华提纯时,图2漏斗颈处棉花球的作用是:过滤二茂铁固体,防止逸散到空气中污染空气,
故答案为:过滤二茂铁固体,防止逸散到空气中;
(5)物质都具有一定的熔点,可以通过测定所得固体的熔点确定二茂铁,
故答案为:测定所得固体的熔点;
(6)c、d结构不同,分子中H原子数目不同,可以利用核磁共振氢谱进行确定,
故答案为:核磁共振氢谱.
点评 本题考查物质合成实验,涉及化学仪器、对操作的分析评价、分液、物质组成及结构的确定等,题目素材中学比较陌生,注意理解有机物合成中产物的确定,难度较大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | HCl | C. | Na2SO4 | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
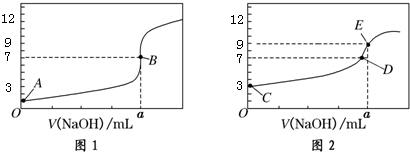
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
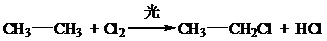 、取代反应
、取代反应 、取代反应.
、取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
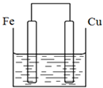 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com