
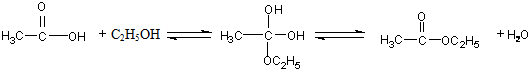
 已知:( i)R1-CH=CH-R2
已知:( i)R1-CH=CH-R2| O3,Zn/H2O |
 与溴发生加成反应生成A为
与溴发生加成反应生成A为 ,在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成 ,
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F、E生成环酯H的分子式可知,C、E、F中含有2个C原子,则C为OHC-CHO,故F为HOCH2CH2OH、E为HOOC-COOH,D为OHCCH2CH2CHO,D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生发生加聚反应得到合成橡胶
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F、E生成环酯H的分子式可知,C、E、F中含有2个C原子,则C为OHC-CHO,故F为HOCH2CH2OH、E为HOOC-COOH,D为OHCCH2CH2CHO,D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生发生加聚反应得到合成橡胶 ,据此解答.
,据此解答. 与溴发生加成反应生成A为
与溴发生加成反应生成A为 ,在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成 ,
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F、E生成环酯H的分子式可知,C、E、F中含有2个C原子,则C为OHC-CHO,故F为HOCH2CH2OH、E为HOOC-COOH,D为OHCCH2CH2CHO,D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生发生加聚反应得到合成橡胶
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F、E生成环酯H的分子式可知,C、E、F中含有2个C原子,则C为OHC-CHO,故F为HOCH2CH2OH、E为HOOC-COOH,D为OHCCH2CH2CHO,D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生发生加聚反应得到合成橡胶 ,
, ,分子中有3种化学环境不同的H原子,故其核磁共振氢谱有3个吸收峰;
,分子中有3种化学环境不同的H原子,故其核磁共振氢谱有3个吸收峰; ,I为HOCH2CH2CH2CH2OH,二者结构不相似,组成通式不同,不是同系物,分子式不同,不是同分异构体,都含有醇羟基,不属于烃,都属于醇类,
,I为HOCH2CH2CH2CH2OH,二者结构不相似,组成通式不同,不是同系物,分子式不同,不是同分异构体,都含有醇羟基,不属于烃,都属于醇类, ,
, ;
; ) 与足量CH3C18OOH在一定条件下完全反应时,由信息可知,羧酸CH3C18OOH与醇发生酯化反应,羧酸中的18O,可能为在水中,也可能在羧基中C=O中,故生成的有机物的结构简式可能为:
) 与足量CH3C18OOH在一定条件下完全反应时,由信息可知,羧酸CH3C18OOH与醇发生酯化反应,羧酸中的18O,可能为在水中,也可能在羧基中C=O中,故生成的有机物的结构简式可能为: ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、29mn | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
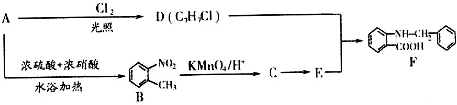
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 硫酸铜/g | 14.8 | 20.5 | 28.5 | 39.6 | 53.6 | 73.0 |
| 硝酸铜/g | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1升溶液中所含阴、阳离子总数是0.6NA |
| B、1升溶液中含有0.2NA个NO3-离子 |
| C、500毫升溶液中的Ba2+离子浓度是0.2mol/L |
| D、500毫升溶液中的NO3-离子浓度是0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com