
| A组 | B组 |
| Ⅰ.H-F键的键能大于H-O键的键能 | ①HF的沸点比H2O低 |
| Ⅱ.H-H…F氢键的键能大于O-H…O氢键的键能 | ②HF比H2O稳定 |
| Ⅲ.HF分子间能形成的氢键个数比H2O分子少 | ③HF的沸点比H2O高 |
| Ⅳ.HF分子与水分子可形成氢键 | ④HF极易溶于水 |
| A. | I② | B. | Ⅱ③ | C. | Ⅲ① | D. | Ⅲ④ |
分析 一般来说,键能越大,物质的热稳定性越强;组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,含有氢键的分子之间作用力较强,沸点较高.
解答 解:A.元素的非金属性越强,原子半径越小,共价键键能越大,则H-F键的键能大于H-O键的键能,所以HF比H2O稳定,B组中命题正确,能用A组命题进行解释,故A不选;
B.HF分子间形成的氢键数目比水分子间氢键数目少,所以HF的沸点比水低,B组中命题错误,不能用A组命题进行解释,故B不选;
C.HF分子间形成的氢键数目比水分子间氢键数目少,所以HF的沸点比水低,B组中命题正确,能用A组命题进行解释,故C不选;
D.HF分子与水分子可形成氢键,所以HF极易溶于水,B组中命题正确,但不能用A组命题进行解释,故D选.
故选D.
点评 本题主要考查了键能与物质的热稳定性、相对分子质量与物质的熔沸点之间的关系,掌握规律是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,⑦的电子式是
,⑦的电子式是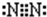 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S 3000C以上完全分解 |

| 实验步骤 | 实验现象和结论 |
| 1.取少量溶液于试管中,滴入几滴KMnO4溶液 | KMnO4溶液颜色由紫色变绿色,说明溶液中大量存在SO32- |
| 2.另取少量溶液于试管中,加入2-3滴酚酞溶液 | 溶液颜色由无色变红,说明溶液中大量存在OH- |
| 3.另取少量溶液于试管中,加入足量1mol•L-1HNO3,再加入少量AgNO3溶液 | 仍有白色沉淀产生,说明溶液中大量存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醛都含有醛基和烃基 | |
| B. | 羟基上氢的活性:羧酸>水>苯酚>醇 | |
| C. | 丁酸与甲酸乙酯互为同分异构体 | |
| D. | 乙二酸是最简单的二元羧酸,具有一定的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NH4Cl溶液的KW大于0.01mol?L-1NH4Cl溶液的KW | |
| B. | 当镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时,升高温度,反应速率v(H2)和H2的平衡转化率α(H2)均增大 | |
| D. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
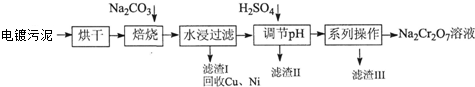
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7[来源:] | 183 | 269 | 415 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com