
【题目】化学反应的本质是旧健的断裂和新健的形成过程,化学键的键能是形成(或拆开)1mol化学键进释放(或吸收)的能量。已知白磷(P4)和P4O6分子结构如下图所示,现提供以下化学键的键能(kJ/mol)P-P:a,P-O:b,O=O:d(a、b、d均为正数)。则反应P4(白磷)+3O2=P4O6的能量变化为( )

A. 吸收(6a-12b)kJ的能量
B. 释放(6a-12b)kJ的能量
C. 释放(12b-6a-3d)kJ的能量
D. 吸收(6a+3d-12b)kJ的能量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】益康唑是一种抗真菌药物,可通过以下方法合成:
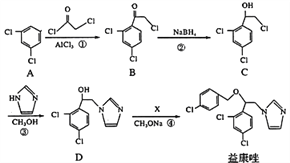
(1)化合物B中含有的官能团名称为________、________;反应②的类型是______反应
(2)反应④中加入的试剂X分子式为C7H6Cl2,则X的结构简式为____________
(3)同时满足下列条件的C的同分异构体一共有_______种;请写出其中任意一种的的结构简式:______________________。
I.能与FeCl3溶液发生显色反应;II.分子中只有2种不同化学环境的氢。
(4)在一定条件下,化合物C与足量氢氧化钠溶液反应的化学方程式为:__________________。
(5)根据本题的相关信并结合已有知识,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(乙醇和无机试剂任用)________。合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(乙醇和无机试剂任用)________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质的溶解性为难溶,则该物质不溶于水
B. 不溶于水的物质溶解度为0
C. 绝对不溶解的物质是不存在的
D. 某离子被沉淀完全是指该离子在溶液中的浓度为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不可能作为原电池工作时发生的反应的是
A. Cu+2AgNO3===Cu(NO3)2+2Ag
B. 2Fe+O2+2H2O===2Fe(OH)2
C. Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3![]() +10H2O
+10H2O
D. 2H2+O2===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.密闭容器中进行的反应N2+3H2![]() 2NH3△H < 0,在一定条件下达到平衡,只改变下列条件,按要求填空:
2NH3△H < 0,在一定条件下达到平衡,只改变下列条件,按要求填空:
(1)增大N2浓度,正反应速率________(填“加快”“减慢”或“不变”)。
(2)缩小容器的体积,增大压强,平衡_______移动(填“向左”“向右”或“不变”)
(3)升高温度,该反应的化学平衡常数(K)将________(填“增大”“减小”或“不变”)
II.有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:
(1)若三种溶液c(H+)依次为C1、C2、C3,则它们的大小关系为______________
(2)分别用以上三种酸中和等量的NaOH生成正盐,若需要酸溶液的体积依次为V1、V2、V3,则其大小关系是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列处置、操作或现象的描述中正确的是
①有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑
②用托盘天平称量50.56 g KCl,0.56 g通过移动游码来实现
③金属钠着火燃烧时,用泡沫灭火器灭火
④让一束光通过胶体,可以看到一条光亮的“通路”
A.③④B.②④C.①④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
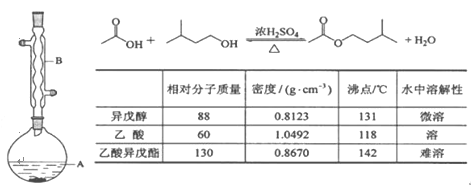
实验步骤:
在A 中加入 4.4 g 异戊醇、6.0 g 乙酸、数滴浓硫酸和 2~3 片碎瓷片。开始缓慢加热 A,回流 50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 MgSO4 固体,静置片刻,过滤除去 MgSO4固体,进行蒸馏纯化,收集 140~143 ℃馏分,得乙酸异戊酯 3.9 g。
(1)仪器 B 的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填序号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4 的目的是________。
(6)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com