
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的沸点依次逐渐升高 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
分析 A.同周期从左向右,非金属性增强;
B.同周期从左向右,原子半径减小;
C.HF分子间含氢键,沸点最高,相对分子质量大的分子的沸点高;
D.同主族,从上到下金属性增强,金属性越强,对应最高价氧化物的水化物碱性越强.
解答 解:A.同周期从左向右,非金属性增强,则第二周期元素从C到F,非金属性逐渐增强,故A错误;
B.同周期从左向右,原子半径减小,则第三周期元素从Na到Cl,原子半径逐渐减小,故B错误;
C.HF分子间含氢键,沸点最高,相对分子质量大的分子的沸点高,则HCl、HBr、HI、HF的沸点依次逐渐升高,故C错误;
D.同主族,从上到下金属性增强,金属性越强,对应最高价氧化物的水化物碱性越强,则LiOH、NaOH、KOH的碱性依次逐渐增强,故D正确;
故选D.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入:_______. | _______,证明固体中含有碳酸氢铵. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的原子核内都有质子和中子 | |
| B. | (H+)实质上是一个裸露的质子 | |
| C. | 核外电子排布相同的微粒,其化学性质也相同 | |
| D. | 非金属元素原子最外层电子数都大于4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为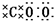 | |
| B. | 所有的主族元素的简单离子的化合价与其族序数相等 | |
| C. | NH4Cl晶体中,既含有离子键,又含有共价键 | |
| D. | 下列物质均为极性分子:H2O、NH3、CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=1,n=5 | B. | m=4,n=3 | C. | m=3,n=4 | D. | m=4,n=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
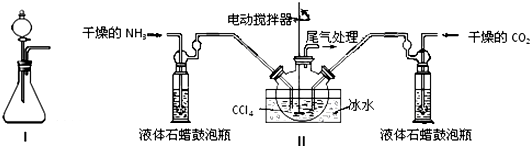
 某课外活动小组用如图1装置进行实验,试回答下列问题.
某课外活动小组用如图1装置进行实验,试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com