
| A. | 24 | B. | 25 | C. | 26 | D. | 27 |
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
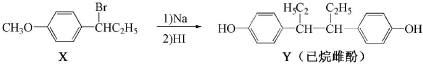
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 596.6 kJ•mol-1,则2 mol C2H2(g)完全燃烧生成气态水时放出的热量大于2 596.6 kJ | |
| B. | 1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,则其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1; ②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1. 则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸遇明火发热爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生氢气,氢气接触空气后遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生氢气接触明火爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的一种单质是自然界硬度最大的晶体 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+1 |
| Z | Z的基态原子L层电子数是K层电子数的3倍 |
| W | W的一种核素的质量数为58,中子数为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
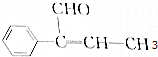 ,下列关于A的叙述中错误的是( )
,下列关于A的叙述中错误的是( )| A. | 在加热和催化剂作用下,能被氢气还原 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在一定条件下能与溴发生取代反应 | |
| D. | 不能与氢溴酸发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

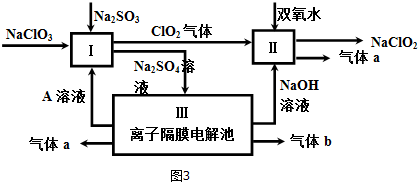
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com