
 3C(g) + D(s), 达到平衡时,C的浓度为1.2 mol·L-1。
3C(g) + D(s), 达到平衡时,C的浓度为1.2 mol·L-1。 3C(g) + D(s),达到平衡时,C的浓度为1.2 mol·L-1。因为2 mol A和1 mol B如果彻底反应则生成3 mol C,所以,若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,要使达到平衡时C的浓度仍是1.2 mol·L-1,则C的起始物质的量应满足的条件是:1.2 mol<n(C)≤3 mol。
3C(g) + D(s),达到平衡时,C的浓度为1.2 mol·L-1。因为2 mol A和1 mol B如果彻底反应则生成3 mol C,所以,若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,要使达到平衡时C的浓度仍是1.2 mol·L-1,则C的起始物质的量应满足的条件是:1.2 mol<n(C)≤3 mol。

科目:高中化学 来源:不详 题型:填空题
 +3
+3
 2
2 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
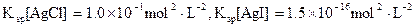 )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
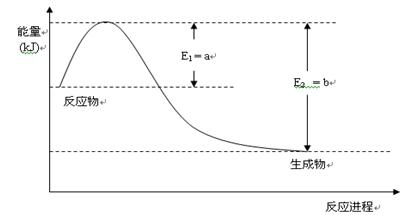
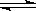 2 SO3 (g) 。
2 SO3 (g) 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是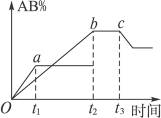
| A.AB为气体,A2、B2中必有一种为非气体;正反应吸热 |
| B.AB为气体,A2、B2中必有一种为非气体;正反应放热 |
| C.AB为固体,A2、B2中必有一种为非气体;正反应放热 |
| D.A2、B2、AB均为气体;正反应吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mZ(g) ΔH="-a" kJ·mol-1(a>0)。现有甲、乙两个容积相等的容器,向甲容器中充入2mol X和1 mol Y,达到平衡时放出热量b kJ;向乙容器中充入1 mol X和0.5 mol Y,达到平衡时放出热量c kJ,且b>2c,则a、b的大小关系及m的值域正确的是( )
mZ(g) ΔH="-a" kJ·mol-1(a>0)。现有甲、乙两个容积相等的容器,向甲容器中充入2mol X和1 mol Y,达到平衡时放出热量b kJ;向乙容器中充入1 mol X和0.5 mol Y,达到平衡时放出热量c kJ,且b>2c,则a、b的大小关系及m的值域正确的是( )| A.a="b" m="3" | B.a>b m≥3 |
| C.a>b m≤2 | D.a<b m≤2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
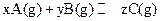 ,平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是( )
,平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是( )| A.X+Y<Z | B.平衡向正反应方向移动 |
| C.B的转化率降低了 | D.C的体积分数增大了 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)+ I2(g)===2HI(g)(正反应是放热反应) |
| B.NH4HCO3===NH3+H2O+CO2(正反应是吸热反应) |
| C.2NO2===N2O4(正反应是放热反应) |
| D.3O2===2O3 (正反应是吸热反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com