
 X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等. 分析 X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质,则X为C元素;Y的单质在空气中含量最高,则Y为O元素.Z 的氧化物是常见的两性氧化物,则Z为Al;R 基态原子最外层成对电子的数目和未成对电子的数目相等,原子序数大于Al,故其核外电子排布为1s22s22p63s23p2,则R为Si,据此解答.
解答 解:X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质,则X为C元素;Y的单质在空气中含量最高,则Y为O元素.Z 的氧化物是常见的两性氧化物,则Z为Al;R 基态原子最外层成对电子的数目和未成对电子的数目相等,原子序数大于Al,故其核外电子排布为1s22s22p63s23p2,则R为Si.
(1)R为Si元素,原子序数为14,位于周期表中第三周期第ⅣA族,故答案为:三;ⅣA;
(2)X、R分别为C、Si元素,非金属性:C>Si,则元素的最高价氧化物对应的水化物酸性:H2CO3>H2SiO3,故答案为:H2CO3;
(3)Y为N元素,处于第二周期,同周期自左而右电负性增大,F元素电负性最强,故答案为:F;
(4)X和R形成的物质为是一种超硬材料为碳化硅,根据晶胞结构图可知,黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白色球数目为4,则每个晶胞中含有X原子的数目为:4,故答案为:4;
(5)X的单质为碳,碳完全燃烧生成的产物为二氧化碳,其结构式为O=C=O,σ 键与 π 键的数目之比是1:1,故答案为:1:1;
(6)Y和Z所形成的化合物ZY为AlN,氮化铝水解生成氢氧化铝和氨气,则AlN在NaOH溶液中反应生成偏铝酸根离子和氨气,反应的离子方程式为:AlN+OH-+H2O=AlO2-+NH3↑,
故答案为:AlN+OH-+H2O=AlO2-+NH3↑.
点评 本题考查位置结构与性质关系的综合应用,题目难度中等,正确推断各元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是氧化物 | |
| B. | 含有K、Cr、O三种元素 | |
| C. | 钾、铬、氧三种元素的质量比为 39:52:112 | |
| D. | 重铬酸钾是由2个钾原子、2个铬原子、7个氧原子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2SO3溶液中:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | 1L0.1mol•L-1CuCl2溶液中:c(Cl-)=2c(Cu2+) | |
| C. | 物质的量浓度相等的Na2S和NaHS的混合溶液中:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) | |
| D. | 室温时,向一定物质的量浓度的CH3COOH溶液中加入一定体积的氢氧化钠溶液,充分反应后溶液的pH=7,则反应后的溶液中:c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
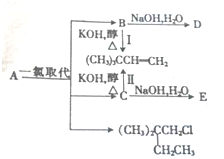 (1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.
(1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+2H+═H2O+CO2↑ | B. | CO32-+H+═H2O+CO2↑ | ||
| C. | CO32-+2HCl═2Cl-+H2O+CO2↑ | D. | Na2CO3+2H+═2Na++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com