
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200 mL C(OH-)= 0.1mol/L的溶液,然后逐滴加入1 mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是 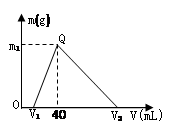
| A.原合金质量为 0.92 g |
| B.图中V2为 60 |
| C.整个加入盐酸过程中 Na+的浓度保持不变 |
| D.Q点m1为1.56 |
D
解析试题分析:由图象可知,向合金溶解后的溶液中加盐酸,先发生NaOH+HCl=NaCl+H2O,后发生NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,最后发生Al(OH)3+3HCl=AlCl3+3H2O,合金溶解后剩余的氢氧化钠的物质的量为0.02mol,
由NaOH+HCl=NaCl+H2O,
0.02mol 0.02mol
生成沉淀时消耗的盐酸为40mL-20mL=20mL,其物质的量为由0.02L×1mol/L=0.02mol,
由 NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,
0.02mol 0.02mol 0.02mol
由钠元素及铝元素守恒可知,合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A错误;由Al(OH)3↓+3HCl=AlCl3+3H2O可知,溶解沉淀需要0.06molHCl,其体积为60mL,则V2为40mL+60mL=100mL,B错误;加入盐酸后溶液体积不断变大,溶液中钠离子浓度不断变小,C项错误;由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故D正确。
考点:钠、铝单质及其化合物的性质,化学方程式的相关计算。
点评:本题考查钠、铝的化学性质及反应,明确发生的化学反应及反应与图象的对应关系是解答本题的关键,并学会利用元素守恒的方法来解答,难度较大。


科目:高中化学 来源: 题型:
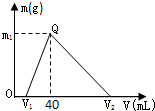 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL C(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL C(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
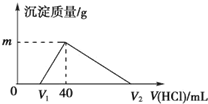 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL的溶液含NaOH 1mol/L,然后滴加1mol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL的溶液含NaOH 1mol/L,然后滴加1mol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A、原合金质量为0.92g | B、图中V2的值为60 | C、图中m的值为1.56 | D、产生氧气的体积为896mL(标准状况下) |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省协作体高三第二次联考(理综)化学部分 题型:选择题
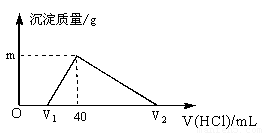
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是[来源:ZX
 XK]
XK]
A.原合金质量为0.92g[来源:Zxxk.Com]
B.产生氢气的体积为896mL(标准状况下)
C.图中m的值为1.56
D.图中V2为60
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三第三次模拟考试(理综)化学部分 题型:选择题
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLpH=14的溶液,然后用1mol·L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是

A.原合金质量为0.92g
B.产生氢气的体积为896mL(标准状况下)
C.图中m的值为1.56
D.图中V2为60
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com