
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
分析 (1)①根据仪器构造可得;
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b;
(2)Cu(NO3)2•3H2O和SOC12发生反应生成硝酸铜、二氧化硫气体和氯化氢气体;
(3)装置B中的氢氧化钠溶液吸收生成的酸性气体,干燥管防止倒吸;
(4)①根据表中数据可知,铁元素应以铁离子的形式除去,硝酸过量保证铁充分氧化为铁离子;
②溶液I为含有铜离子和铁离子的溶液,应加Cu(OH)2或Cu2(OH)2CO3调节pH沉淀铁离子,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤冰水洗涤得到Cu(NO3)2•3H2O晶体.
解答 解:(1)①由构造可知仪器c为球形干燥管;
故答案为:球形干燥管;
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b;
故答案为:b;
(2)Cu(NO3)2•3H2O和SOC12发生反应生成硝酸铜、二氧化硫气体和氯化氢气体,化学方程式为:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑;
故答案为:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑;
(3)装置B中的氢氧化钠溶液吸收生成的酸性气体SO2和HCl,防止污染空气,干燥管防止液体倒吸;
故答案为:吸收SO2和HCl,防止倒吸;
(4)①根据表中数据可知,铁元素应以铁离子的形式除去,硝酸过量保证铁充分氧化为铁离子;
故答案为:将铁元素全部转化为Fe3+;
②溶液I为含有铜离子和铁离子的溶液,应加Cu(OH)2或Cu2(OH)2CO3调节3.2<pH<4.2沉淀铁离子,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤冰水洗涤得到Cu(NO3)2•3H2O晶体;
故答案为:Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤.
点评 本题考查了物质的制备,涉及了元素的相关性质,实验设计,操作控制,方程式的书写等,要求学生对物质基本性质的掌握,并加以灵活运用,题目难度中等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
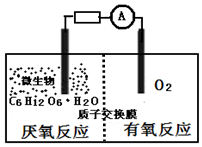 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从正极区移向负极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体与62gNa2O固体中阴、阳离子总数均为3NA | |
| B. | 在2H2O+2Na2O2=4NaOH+O2↑的反应中,当产生标况下5.6LO2时,转移的电子数为NA | |
| C. | 1mol SiO2分子中含NA个Si原子和2NA个氧原子 | |
| D. | 54g铝与足量的稀硝酸反应产生的氢气分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 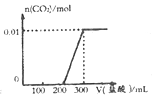 | ||
| C. |  | D. | 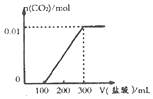 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
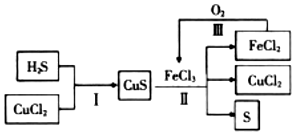
| A. | 在转化过程中化合价不变的元素只有Cu和Cl | |
| B. | 反应II中每生成1.25molS需要2.5molFeCl3 | |
| C. | 在转化过程中能循环利用的物质有FeCl2和CuCl2 | |
| D. | 反应Ⅲ中消耗1molO2时,可转化4mol的FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与水蒸气反应 | B. | Zn和稀H2SO4反应制氢气 | ||
| C. | Ba(OH)2•8H2O和NH4Cl反应 | D. | HCl溶液和NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量 | |
| B. | 436kJ/mol是指断开1molH2 中的H-H键需要放出436kJ的能量 | |
| C. | 431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量 | |
| D. | 氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com