
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移的电子数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| C. | 在30g二氧化硅晶体中含有的共价键数目为2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体冷却至标准状况,其体积约为22.4L |
分析 A、过氧化钠和水反应时,氧元素的价态由-1价变为0价;
B、气体所处的状态不明确;
C、求出二氧化硅的物质的量,然后根据1mol二氧化硅中含4mol硅氧键来分析;
D、NO2中存在平衡:2NO2?N2O4.
解答 解:A、过氧化钠和水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故A错误;
B、氧气所处的状态不明确,故转移的电子数无法计算,故B错误;
C、30g二氧化硅的物质的量为n=$\frac{30g}{60g/mol}$=0.5mol,而1mol二氧化硅中含4mol硅氧键,故0.5mol二氧化硅中含2mol硅氧键即2NA个,故C正确;
D、NO2中存在平衡:2NO2?N2O4,且反应放热,故将常温下含NA个NO2、N2O4分子的混合气体冷却至标准状况,平衡右移,则分子数小于NA个,体积小于22.4L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+28.7 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-28.7 kJ/mol | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
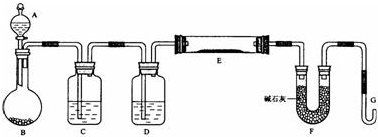
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
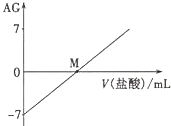 溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )| A. | 室温下,0.01 mol•L-l盐酸的AG=12 | B. | M点时溶液中:c(NH4+)=c(Cl-) | ||
| C. | M点加入盐酸的体积大于20.00 mL | D. | M点以后NH4+的水解程度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
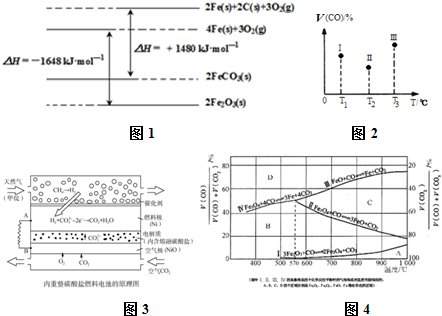
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到稳定结构.
H2O和CS2分子中的原子都达到稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用电池外壳的金属材料 | |
| B. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中石墨电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com