
| A. | 4种 | B. | 2种 | C. | 3种 | D. | 1种 |
分析 标况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,故14g金属提供的电子为0.5mol×2=1mol,结合化合价计算提供1mol电子需要各金属的质量,混合各组分的质量满足都等于14g或满足有的组分小于14g、有的组分大于14g,据此进行判断.
解答 解:标况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,故14g金属提供的电子为0.5mol×2=1mol,
Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×$\frac{1mol}{2}$=32.5g,
Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×$\frac{1mol}{2}$=28g,
Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×$\frac{1mol}{3}$=9g,
Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×$\frac{1mol}{2}$=12g,
根据分析可知,满足14g混合金属能够提供1mol电子的组合有:Zn和Al、Zn和Mg、Fe和Al、Fe和Mg,总共有4种,
故选A.
点评 本题考查混合物的计算,题目难度中等,注意利用平均值法解答较为简单,注意若有不反应的金属应视作需金属质量无穷大,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖水解(用稀H2SO4作催化剂)后的溶液中直接加少量新制Cu(OH)2加热有砖红色沉淀产生 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在苯中滴入浓硝酸制硝基苯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 金刚石和石墨 | ||
| C. | CH3CH=CH2和环丙烷 | D. | 丁烷和异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
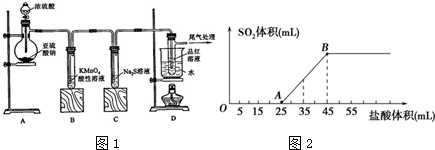
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的平衡常数越大,反应进行的速率越快 | |
| B. | 加热、蒸干NaAlO2溶液和AlCl3溶液,并灼烧都得到Al2O3 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| D. | 0.1mol•L-1CH3COONa溶液中加入少量固体NaOH,碱性增强,平衡向水解方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
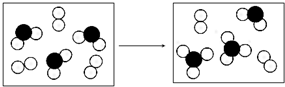
 .
. .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com