
| A、滴加甲基橙溶液呈黄色 | ||||
| B、c(HCO3-)>c(H2CO3)>c(CO32-) | ||||
| C、c(OH-)=c(H+)+c(H2CO3)-c(CO32-) | ||||
D、加水稀释,
|
| c(H2CO3) | ||
c(HC
|


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
A、 与 与 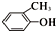 属于同素异形体 属于同素异形体 |
| B、CH3COOH与硬脂酸(C17H35COOH)属于同系物 |
C、 与 与  属于同一种物质 属于同一种物质 |
D、 与 与 属于同分异构体 属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
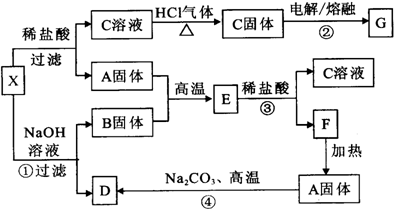 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.查看答案和解析>>
科目:高中化学 来源: 题型:
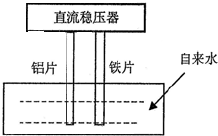 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Fe3+、SO42-、I- |
| B、H+、NH4+、HCO3-、NO3- |
| C、Ag+、K+、Cl-、SO42- |
| D、K+、AlO2-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
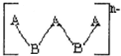 主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )
主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )| A、n=2 |
| B、A是第ⅡA族元素 |
| C、A为-2价,B为+2价 |
| D、该离子没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度/mol.L-1 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com