
科目:高中化学 来源: 题型:
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。
回答下列问题:
(1)B的分子式为C2H4O2,分子中只有一个官能团。则B的结构简式是________,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是_____________。
该反应的类型是________;写出两种能发生银镜反应的B的同分异构体的结构简式____________________, ____________________;
(2)C是芳香化合物,相对分子质量为180。其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是________;
(3)已知C的芳环上有三个取代基。其中一个取代基无支链,且含有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是________;另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是__________________。
(4)A的结构简式是___________________________。
(5)写出化合物A(C11H8O4)在氢氧化钠溶液中加热反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=_________________________。
(2)降低温度,该反应K______,二氧化硫转化率________,化学反应速率________(填“增大”、“减小”或“不变”)。
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3的物质的量变化如图,反应处于平衡状态的时间___________________。
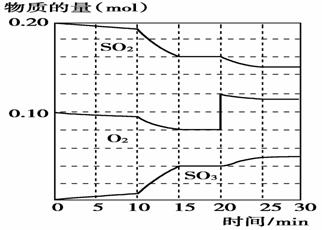
(4)据图判断,反应进行至20 min 时,曲线发生变化的原因是(用文字表达)________________________ _____________ __;
10 min到15 min时曲线变化的原因可能是(填写编号)________。
a.加了催化剂 b.缩小了容器体积 c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是: ( )
A.汽油燃烧时将全部的化学能转化为热能
B.向饱和AgCl溶液中加入盐酸,Ksp变大
C.若存在简单阴离子R2-,则R一定属于VIA族
D.最外层电子数少的金属元素,一定比最外层电子数多的金属元素活泼性强
查看答案和解析>>
科目:高中化学 来源: 题型:
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
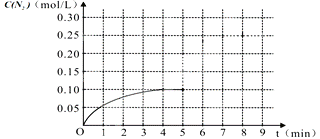
①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为
0.25 mol/L)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,在一定条件下,用CH4还原NOX可以消除氮氧化物的污染。
 例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
写出CH4还原N2O4(g)生成N2和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放目的。通过人工光合作用,以CO2和H2O为原
料可以制备HCOOH和O2,计算标况下每回收1.0m3 CO2转移的电子数为 个。
③常温下,0.1mol/L的HCOONa溶液的pH为10,则HCOOH的电离常数Ka = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子在指定的分散系中能大量共存的一组是 ( )
A.银氨溶液:Na+、K+、NO3-、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、B-
D.高锰酸钾溶液:H+、Na+、S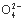 、葡萄糖分子
、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸的结构简式为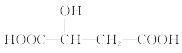 ,下列说法正确的是( )
,下列说法正确的是( )
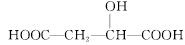 A. 与苹果酸互为同分异构体
A. 与苹果酸互为同分异构体
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D. 四联苯的一氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
用光洁的铂丝蘸取某无色溶液,在无色灯焰上灼烧,观察到黄色火焰,则下列有关该无色溶液的叙述正确的是:
A.只含有Na+ B. 可能含Na+或K+的一种
C.一定含有Na+和K+ D.一定含Na+,也可能含K+
查看答案和解析>>
科目:高中化学 来源: 题型:
联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
工业上有一种方法是用CO2来生产燃料甲醇,298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图1所示,据图回答问题:
(1)写出合成甲醇反应的热化学方程式 ;
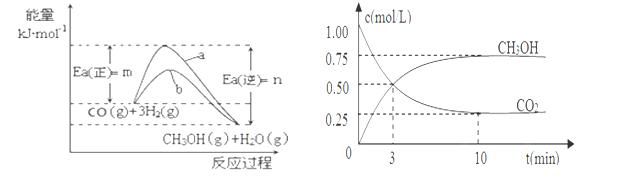 图1 图2
图1 图2
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________ 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com