
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
|
| A. | A、B、C、D、E | B. | E、C、D、B、A | C. | B、A、D、C、E | D. | C、D、A、B、E |
考点:
元素周期律和元素周期表的综合应用.
专题:
元素周期律与元素周期表专题.
分析:
同周期元素从左到右原子半径逐渐减小,对应的元素的金属性逐渐减弱,非金属性逐渐增强,根据对应化合物的碱性、稳定进行判断.
解答:
解:A和B的最高价氧化物对应的水化物均呈碱性,则都为金属,且碱性B>A,同周期元素从左到右元素的金属性逐渐减弱,对应的最高价氧化物的水化合逐渐减弱,则原子序数A>B,
同周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增强,C和D的气态氢化物的稳定性C>D,则原子序数C>D;E是这五种元素中原子半径最小的元素,原子序数最大.
则原子序数为:B<A<D<C<E,
故选C.
点评:
本题考查元素周期律的递变规律,题目难度中等,注意元素的金属性、非金属性与对应化合物的性质.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
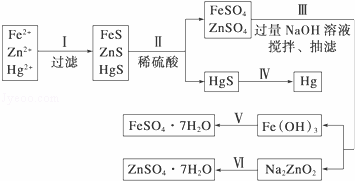
某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4•7H2O)和汞的方案.
NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
如图
(1)步骤Ⅱ所发生反应的离子方程 .
步骤Ⅲ中抽滤的目的是 ,该步骤产生Fe(OH)3的反应的离子方程式为 .
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为 .
(4)欲实现步骤Ⅴ,需加入的试剂有 、 ,所涉及的主要操作依次为 .
(5)步骤Ⅳ常用的方法是 ,该步骤是否对环境有影响? (填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应: .
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物中,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
A. 1﹣溴丁烷 B. 2﹣甲基﹣3﹣氯戊烷
C. 2,2﹣二甲基﹣1﹣氯丁烷 D. 1,3﹣二氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A只含C、H、O三种元素,其相对分子质量为76.为测定A的化学式,取3.8克的A置于密闭容器中完全燃烧,将燃烧产物通过盛有浓硫酸的试剂瓶,试剂瓶增重3.6克,继续通过盛有饱和氢氧化钠溶液的试剂瓶,试剂瓶增重6,6克.
(1)A的分子式为 ;
(2)A只含有一种官能团,且红外光谱图如图1: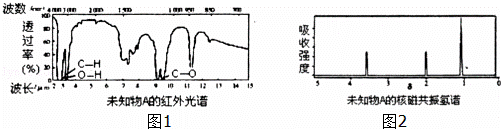
据此推断A可能的结构简式为:(已知:同一个碳原子上连接两个羟基是不稳定的结构)
, ;
(3)若A的核磁共振氢谱只有三个吸收峰,请写出A与足量金属钠反应的化学方程式: ;
请写出A与氧气(加热,铜做催化剂)反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
|
| A. | Y元素最高价氧化物对应的水化物化学式H2YO4 |
|
| B. | 原子半径由小到大的顺序为:X<Z<Y |
|
| C. | Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定 |
|
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com