
 .
. 分析 (1)同周期随原子序数增大第一电离能呈增大趋势,但第二周期中,铍元素原子2s能级容纳2个电子,处于全满稳定状态,能量较大,失去电子较难,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量较大,失去电子较难;
(2)原子的左下角为质子数,核外电子数=质子数+得到电子数,根据能量最低原则、泡利不相容原理和洪特规则综合考虑,写出核外电子排布式;
(3)Fe3+的外围电子为3d5,据此书写轨道表示式.
解答 解:(1)同周期随原子序数增大第一电离能呈增大趋势,但第二周期中,铍元素原子2s能级容纳2个电子,处于全满稳定状态,能量较大,失去电子较难,第一电离能高于B元素,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量较大,失去电子较难,第一电离能高于O元素,故第二周期元素第一电离能的排列顺序由低到高排列的为:Li B Be C O N F Ne,故答案为:Li B Be C O N F Ne;
(2)34Se2-所含质子数为34,原子核外电子数为34+2=36,根据能量最低原则、泡利不相容原理和洪特规则写出为[Ar]3d104s24p6,
故答案为:[Ar]3d104s24p6;
(3)Fe3+的外围电子为3d5,则轨道表示式 ,故答案为:
,故答案为: .
.
点评 本题考查物质结构与性质,涉及核外电子排布、电离能、轨道表示式等,难度中等,注意基础知识的积累.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:多选题
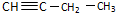 ,而不是
,而不是 的事实是( )
的事实是( )| A. | 燃烧有浓烟 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 所在原子不在同一平面上 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子有可能都在同一直线上 | |
| B. | 在同一直线上的碳原子可能为4个 | |
| C. | 分子中所有原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,若溶液的pH=11,则Kb(NH3•H2O)=1×10-6 | |
| B. | 向溶液中加入少量CH3COONa固体,溶液中$\frac{c(N{H}_{3}.{H}_{2}O)}{c(N{H}_{4}^{+})}$的值变小 | |
| C. | 向溶液中加入10 mL 0.1 mol•L-1盐酸,所得溶液中离子浓度大小顺序为:c(NH4+)>(Cl-)>c(H+)>c(OH-) | |
| D. | 向溶液中加入5 mL 0.1 mol•L-1盐酸,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子半径大于Y | |
| B. | 若X为ⅠA族元素,则该化合物中含离子键 | |
| C. | 若X2Y的焰色为黄色,则它的电子式是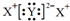 | |
| D. | 若每个X2Y分子中含有10个电子,则Y是第3周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据一次能源与二次能源的划分,氢气为二次能源 | |
| B. | 空气、水、煤、天然气均为可再生资源 | |
| C. | 镁条燃烧时将部分化学能转化为光能 | |
| D. | 在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的用量 | B. | 增大反应体系的压强使体积改变 | ||
| C. | 升高体系的反应温度 | D. | 将容器的体积缩小一半 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com