
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯在一定条件下都能与水反应 | 二者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯使溴水褪色是苯萃取溴水的溴;
B.乙酸含有羧基显酸性,能与NaHCO3溶液反应;
C.淀粉和纤维素都是高分子化合物,分子式不同;
D.乙酸乙酯与水的反应水解反应,乙烯与水的反应属于加成反应.
解答 解:A.乙烯含有C=C双键,与溴发生加成反应,使溴水褪色,苯使溴水褪色是苯萃取溴水的溴,苯分子中不含碳碳双键,故A错误;
B.乙酸含有羧基显酸性,乙酸的酸性大于碳酸,所以乙酸能与NaHCO3溶液反应生成二氧化碳,故B正确;
C.淀粉和纤维素都是高分子化合物,分子式不同,不是同分异构体,故C错误;
D.乙酸乙酯与水的反应水解反应,乙烯与水的反应属于加成反应,反应类型不同,故D错误;
故选B.
点评 本题考查苯、乙烯、乙酸、酯、葡萄糖的性质等,比较基础,注意A选项中苯使溴水褪色原理是发生了萃取是物理变化,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
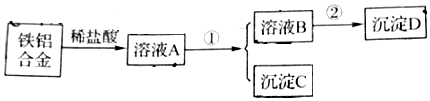
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
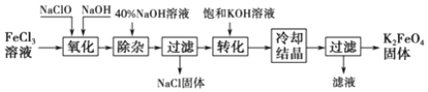
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
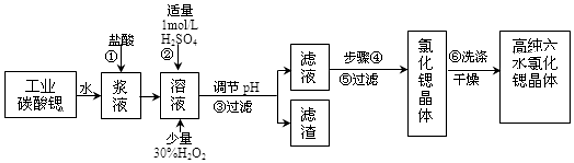
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
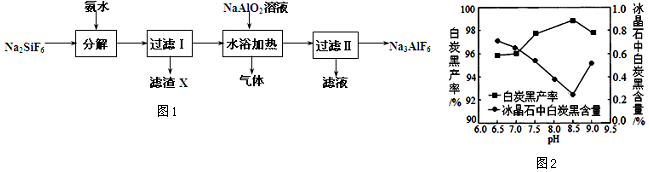
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气和氢气不再发生反应时的状态 | |
| B. | 体系中的总压强不变时的状态 | |
| C. | 氮气的浓度与氢气的浓度之比为1:3时 | |
| D. | 混合物的密度保持不变时的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com