
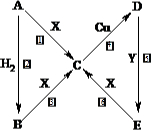
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G| 高温 |
| ||
. |
| ||
| ||
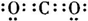
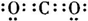
| 高温 |
| ||
| 高温 |
| ||
| ||
| ||
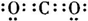 ,故答案为:
,故答案为: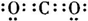 ;直线型;
;直线型;
| ||


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
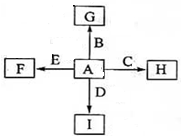 如图中,A、B、C、D、E是常见单质,G、H、I、F是B、C、D、E分别和A形成的化合物.已知:①反应2C+G
如图中,A、B、C、D、E是常见单质,G、H、I、F是B、C、D、E分别和A形成的化合物.已知:①反应2C+G
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省、周宁一中高三第四次联考理综化学试卷(解析版) 题型:填空题
如图中,A、B、C、D、E是单质G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
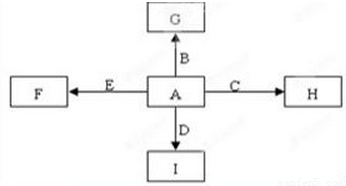
①若G为红棕色固体,反应C+G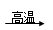 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为______________________________;
(2)3.2 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量为
(3)C与过量NaOH溶液反应的离子方程式为______________________,
(4)E在I中燃烧观察到的现象是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中,A、B、C、D、E是常见单质,G、H、I、F是B、C、D、E分别和A形成的化合物.已知:①反应2C+G
如图中,A、B、C、D、E是常见单质,G、H、I、F是B、C、D、E分别和A形成的化合物.已知:①反应2C+G 2B+H,并放出大量的热,该反应可用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
2B+H,并放出大量的热,该反应可用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%.
2F+D,F中E元素的质量分数为60%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com