
分析 绿矾样品被氧化会生成Fe3+,Fe3+可使KSCN溶液会变血红色,Fe2+能使酸性KMnO4溶液褪色,Fe3+与Fe反应生成Fe2+,以此解答该题.
解答 解:(1)绿矾样品没有被氧化,则不含Fe3+,滴加KSCN溶液,则现象为溶液不变色,
故答案为:KSCN溶液;溶液不变色;
(1)绿矾样品被氧化会生成Fe3+,有Fe3+存在即可明绿矾样品已被氧化,Fe3+可使KSCN溶液会变血红色,则现象为溶液为血红色,另取少量加高锰酸钾溶液不褪色,
故答案为:KSCN溶液、高锰酸钾;加KSCN溶液变为血红色,另取少量加高锰酸钾溶液不褪色;
(2)Fe2+能使酸性KMnO4溶液褪色,若溶液不褪色,说明溶液中没有Fe2+,则证明绿矾样品完全被氧化,故答案为:溶液不褪色;
(3)说明其部分被氧化,则溶液中含Fe3+、Fe2+,实验方法为取少量滴加KSCN溶液会变血红色,另取少量加高锰酸钾溶液褪色,
故答案为:取少量滴加KSCN溶液会变血红色,另取少量加高锰酸钾溶液褪色.
点评 本题考查物质的检验实验设计,为高频考点,把握物质的性质、发生的反应及离子检验方法为解答的关键,侧重分析与实验能力的考查,注意试剂的选择及现象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | 0.040 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③④ | C. | ③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Ba2+、CO32- | B. | K+、Na+、Ag+、Cl- | ||
| C. | H+、Mg2+、HCO3-、SO42- | D. | Ba2+、Cl-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{d}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
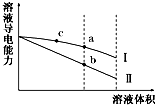 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )| A. | 两溶液稀释前的浓度相同 | |
| B. | a、b、c三点溶液的pH由大到小顺序为a>b>c | |
| C. | a点的KW值比b点的KW值大 | |
| D. | a点水电离的c(H+)大于c点水电离的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所带电荷数SO42-是Na+的0.6倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | c(NH+4)相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,pH大小:①>②>③ | |
| B. | 0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com