
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
【答案】
(1)3FeCO3+10H++NO3﹣=3Fe3++NO↑+3CO2↑+5H2O
(2)Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
(3)防止H2O2分解,提高其利用率;降低CaO2?8H2O溶解度,提高产率
(4)偏高;在酸性条件下空气中的O2也可以把KI氧化为I2 , 使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
【解析】解:碳酸钙、碳酸镁与稀硝酸反应生成硝硝酸钙、硝酸镁与二氧化碳,碳酸亚铁与稀硝酸反应生成硝酸铁、二氧化碳、NO,溶液中加入浓氨水,镁离子、铁离子转化为氢氧化镁、氢氧化铁沉淀,过滤除去,滤液中加入碳酸铵将硝酸钙转化为碳酸钙,过滤分离得到碳酸钙,再与盐酸反应生成氯化钙,在加入过氧化氢、氨气得到反应得到CaO2 , 溶液冷却结晶得到CaO28H2O,副产品中含有氯化铵,(1)反应①中只有FeCO3与硝酸反应是氧化还原反应生成硝酸铁、一氧化氮、二氧化碳和水,反应方程式为:3FeCO3+10H++NO3﹣=3Fe3++NO↑+3CO2↑+5H2O,
所以答案是:3FeCO3+10H++NO3﹣=3Fe3++NO↑+3CO2↑+5H2O;(2)加入氨水使Mg2+、Fe3+沉淀完全,反应的离子方程式为:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ , Fe3++3NH3H2O=Fe(OH)3↓+3NH4+ ,
所以答案是:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ , Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;(3)H2O2受热易分解,采用冰水控制温度在0℃左右,防止其分解,提高利用率,同时温度低能降低CaO28H2O溶解度,提高产率,
所以答案是:防止H2O2分解,提高其利用率;降低CaO28H2O溶解度,提高产率;(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能偏高,因为在酸性条件下空气中的O2也可以把KI氧化为I2 , 使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高;
所以答案是:偏高;在酸性条件下空气中的O2也可以把KI氧化为I2 , 使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】含CuSO4和H2SO4的混合溶液200mL,其中CuSO4物质的量浓度为1molL﹣1 , H2SO4物质的量浓度为0.5molL﹣1 , 若用此溶液配成0.2molL﹣1 CuSO4和2molL﹣1 H2SO4的混合溶液,试求:
(1)所得溶液的体积是多少毫升?
(2)需加入密度为1.84gcm﹣3、98%的浓硫酸多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乃焰硝、硫磺、杉木炭所合,以为烽燧铳机诸药者”是对我国古代四大发明之一的火药的描述。其中,“焰硝”是
A.KClO3B.Na2SO4C.KNO3D.Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子化合物的熔点与离子的半径、离子所带的电荷有关,离子的半径越小,离子所带的电荷越高,则离子化合物的熔点就越高。试判断KCl、CaO两种晶体熔点的高低顺序:
A. KCl>CaOB. NaCl=CaOC. CaO>KClD. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写不正确的是( )
A.在空气中加热钠:2Na+O2 ![]() Na2O2
Na2O2
B.向FeCl3溶液中滴加淀粉碘化钾溶液:2Fe3++2I﹣═2Fe2++I2
C.铁与水蒸气反应:2Fe+3H2O(g) ![]() Fe2O3+3H2
Fe2O3+3H2
D.硅酸钠溶液中滴入稀盐酸:Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.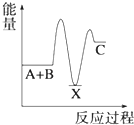
B.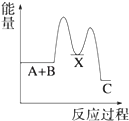
C.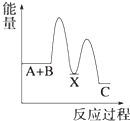
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. 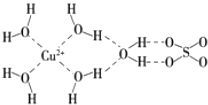
(1)写出基态Cu原子的核外电子排布式 .
(2)写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) .
(3)将胆矾溶于水得到天蓝色溶液,往溶液中逐滴加入氨水,现象为 , 反应的离子方程式为 .
(4)已知NF3与NH3的立体结构相同,但NF3不易与Cu2+形成配离子,其原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com