
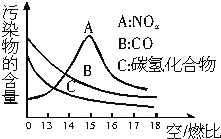
 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.分析 (1)根据稀薄燃烧技术产生的污染尾气较少来分析; 根据常用的汽车尾气净化装置不能有效地将NOx转化为N2来分析;
(2)催化剂不同催化效果不同,可将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同),测量并记录的溶液显色的时间;
(3)A,汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3;
或B,汽车尾气中含有一定量的NO2,多消耗NH3;
或C,汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少.
解答 解:(1)因为稀薄燃烧技术产生的污染尾气较少,所以还具有的优点是减少CO和碳氢化合物的污染; 但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2,所以NOx会导致酸雨、光化学烟雾或破坏臭氧层;故答案为:减少CO和碳氢化合物的污染;光化学烟雾或破坏臭氧层;
(2)溶液显色的时间不同,说明催化剂的催化效果不同,故答案为:溶液显色所需要的时间;
(3)若A,汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3;
或B,汽车尾气中含有一定量的NO2,多消耗NH3;
或C,汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少,
故答案为:B;汽车尾气中含有一定量的NO2,多消耗NH3.
点评 本题考查了催化剂对化学平衡的影响及化学实验方案的评价,题目难度中等,注意明确催化剂对化学反应速率的影响,正确解读题目给出的信息是解决信息性题目的关键,要善于从信息中捕捉最有效的信息用来处理问题.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序列 | 参加反应的物质 | 生成物 |
| ① | MnO4- … | Cl2、Mn2+ … |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 … |
| A. | 第①组反应中生成0.5mol Cl2,转移电子1mol | |
| B. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应的其余产物为H2O和 O2 | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I-可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50mL该溶液与过量Zn充分反应,生成0.56gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有3NA个NH4+ | |
| B. | 标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L | |
| C. | 10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA | |
| D. | 1L 1mol•L-1的碳酸钠溶液中钠离子的数目小于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com