
【题目】以Fe3+/Fe2+作为氧化还原介质,可以在低电位条件下电解HCl制取Cl2,其原理如图所示,下列说法正确的是( )
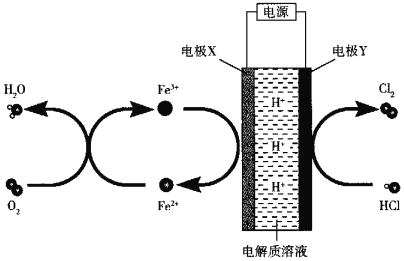
A.X极上的电势比Y极上的低
B.![]() 向Y极迁移,X极周围溶液pH升髙
向Y极迁移,X极周围溶液pH升髙
C.X极上发生反应:![]()
D.电解总反应为![]()
【答案】A
【解析】
A、根据装置图中Y电极上HCl失去电子、被氧化生成Cl2可知,Y电极为电解池的阳极,与电源正极相接,则电极X为电解池的阴极,与电源负极相接,所以Y极上的电势比X极上的高,故A正确;
B、Y电极为电解池的阳极,电极X为电解池的阴极,阳离子H+向X极迁移,X极周围溶液酸性增强、pH减小,故B错误;
C、由图可知,阴极X电极发生得电子的还原反应、电极反应式为Fe3++e-=Fe2+,故C错误;
D、电解时,阳极上反应式为2HCl-2e-=2H++Cl2↑,阴极上反应式为Fe3++e-=Fe2+,生成的Fe2+与O2反应生成Fe3+、循环转化的方程式为4Fe2++O2+4H+=4Fe3++2H2O,所以电解总反应为4HCl+O2=2Cl2+2H2O,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2
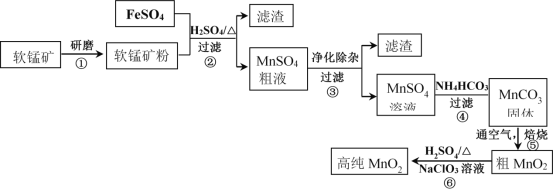
(1)步骤①中研磨的目的是______________________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与__________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。
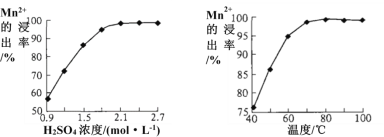
软锰矿粉酸浸的适宜条件是________________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol·L-1
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____________________。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
A.Na2CO3 B.MnCO3 C.Na2S D.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥ B. ②③⑤ C. 全部 D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________,含有的官能团为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的产物,某同学选用了如图所示的实验装置。下列说法错误的是( )
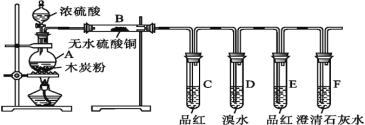
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.F装置用来检验产物中是否有CO2生成
D.将装置B与C位置互换,仍可以达到实验目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是
A. 1molCS2分子中含有1NA个π键
B. 31g白磷(P4)分子中所含的共价键数目为1NA
C. 电解精炼铜时,若阳极质量减少64g,则阴极转移的电子数目一定为2NA
D. 在1mol[Cu(H2O)4]2+中含有12NA个![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
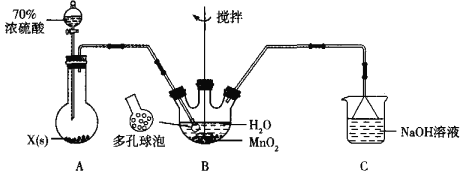
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
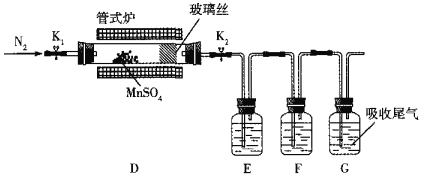
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示

①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A.仅①③B.仅①③⑤C.仅②④D.仅②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用反应Cr2O7n-+CH3OH+H+→Cr3++CO2↑+H2O(未配平)来测定工业甲醇中甲醇的含量,下列说法中正确的是( )
A. 溶液的颜色从灰绿色变为橙色
B. Cr2O7n-发生氧化反应
C. 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2
D. 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com