
元素A和B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a﹣2b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )
|
| A. | 能与水反应 | B. | 能与氢氧化钠溶液反应 |
|
| C. | 能与硫酸反应 | D. | 能与碳酸钠溶液反应 |
| 原子结构与元素周期律的关系. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | 元素A和B的原子序数都小于18.B元素原子的M层电子数为(a﹣b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素的次外层为K层,即b=2,有2个电子层,所以a=8﹣2=6,故A为氧元素,B为的M层电子数为6﹣2=4,故B为硅元素,A、B两元素所形成的化合物为SiO2,结合物质的性质解答. |
| 解答: | 解:元素A和B的原子序数都小于18.B元素原子的M层电子数为(a﹣b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素的次外层为K层,即b=2,有2个电子层,所以a=8﹣2=6,故A为氧元素,B为的M层电子数为6﹣2=4,故B为硅元素,A、B两元素所形成的化合物为SiO2, A.二氧化硅不与水反应,故A错误; B.二氧化硅与氢氧化钠反应生成硅酸钠与水,故B正确; C.二氧化硅能与氢氟酸反应,不能与其它酸反应,故C错误; D.二氧化硅不与碳酸钠溶液反应,故D错误, 故选B. |
| 点评: | 本题以元素推断为载体,考查核外电子排布规律、二氧化硅的性质,难度不大,理解核外电子排布规律,推断元素是解题关键. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
2011年3月11日下午13时46分(北京时间)日本发生9.0级强烈地震并引发海啸,日本遭受了二战以来最严重的灾难,地震导致福岛核电站遭受损坏而发生了核泄漏,引起亚洲及世界各国人民的高度关注。其中核泄露的一种放射源是碘—131,下列说法不正确的( )
A.碘—131原子核外有5个电子层 B.碘—131原子的最外层有7个电子
C.具有放射性的碘—131原子比普通碘—127原子多4个中子
D.131I2与127I2互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
新兴的大脑营养学研究发现,大脑生长发育与不饱和脂肪酸有密切关系.从深海鱼油中提取的被称为“脑黄金”的DHA就是一种不饱和程度很高的脂肪酸,它的分子组成中有6个碳碳双键、学名二十六碳六烯酸.它的分子组成应是( )
|
| A. | C25H50COOH | B. | C25H39COOH | C. | C26H41COOH | D. | C26H47COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于现有元素周期表的说法不正确的是( )
|
| A. | 编排的总原则是按元素的核电荷数递增的顺序排列,且将电子层数相同的元素排成同一行,将最外层电子数相同的排成同一列 |
|
| B. | 一个族就是一列,一个周期就是一个横行 |
|
| C. | 指导人们在金属与非金属元素的分界线附近寻找半导体材料 |
|
| D. | 指导人们在过渡元素中寻找合适的有机反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下2L的密闭容器中发生反应:2X(g)+3Y(g)⇌2Z(g),测得X、Y、Z的浓度分别为0.2mol/L、0.3mol/L、0.4mol/L,再经过10分钟时反应达到平衡状态,下列结论不正确的是( )
|
| A. | 若起始时加入容器的只有反应物X、Y,则起始加入的X、Y的物质的量之比一定是2:3 |
|
| B. | 若起始时加入容器的有X、Y、Z,则起始时加入的X、Y的物质的量之比一定是2:3,而Z的物质的量一定小于1.2mol |
|
| C. | 达到平衡状态时,Z的浓度可能是0.1mol/L也可能是0.6mol/L |
|
| D. | 达到平衡状态时,X的浓度可能是0.1mol/L也可能是0.4moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下容积为10L的密闭容器中加入一定量的SO2、O2并发生如下反应:2SO2(g)+O2(g)⇌2SO3(g),经过10分钟测得容器中三种物质SO2、O2、SO3的物质的量分别为3mol、9mol、2mol,再经过t分钟时反应达到了平衡状态,且已知平衡状态时SO2的转化率为80%(提示:SO2的转化率是指反应掉的SO2占原来SO2总量的百分数),回答下列问题:
(1)前10分钟SO2的平均反应速率为 ,10分钟时该反应是否达到平衡状态
(填“是”、“否”、“不一定”),开始时加入容器中的O2的物质的量为 ;
(2)平衡状态时容器中O2的浓度为 ,关于t分钟的下列说法正确的是 ;
A.t肯定大于10
B.t肯定小于10
C.t一定等于10
D.t可能大于10、也可能等于或小于10
(3)改变温度化学平衡发生移动,最后重新达到新的平衡状态,在新平衡状态下测得各物质的浓度数据如下,其中合理的是 ;
A.c(SO2)=0.2mol/L,c(O2)=0.8mol/L,c(SO3)=0.3mol/L
B.c(SO2)=0.2mol/L,c(O2)=0.85mol/L,c(SO3)=0.3mol/L
C.c(SO2)=0.2mol/L,c(O2)=0.8mol/L,c(SO3)=0.4mol/L
D.c(SO2)=0.05mol/L,c(O2)=0.775mol/L,c(SO3)=0.35mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
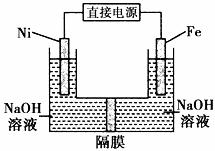 A.镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
A.镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B.电解时电流的方向为:负极→Ni电极→溶液→Fe
电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是 ( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化剂中,起氧化作用的是X2O72﹣,在溶液中0.2mol该离子恰好能使0.6mol SO32﹣离子完全氧化,则X2O72﹣离子被还原后的化合价为( )
|
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com