
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硝酸钾 硫酸钠 氯化钙 氯化钡 |
| B.硫酸 硫酸铝 氯化钠 氢氧化钠 |
| C.盐酸 硫酸钠 碳酸钠 硝酸钠 |
| D.硫酸氢钠 氯化镁 氢氧化钡 硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
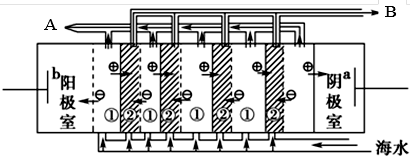
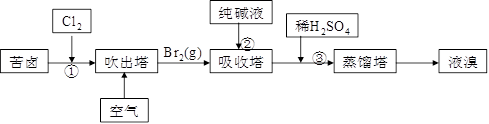
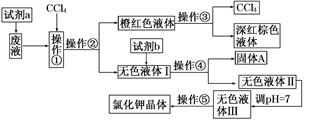
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将AlCl3溶液蒸发结晶提取无水AlCl3 |
| B.在温水瓶中加入Na2CO3溶液浸泡后加入盐酸能除去内壁的CaSO4 |
| C.用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 |
| D.用酸性KMnO4溶液除去乙烷中混有的少量乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.检验亚硫酸钠试样是否变质: |
B.除去乙酸乙酯中混有的乙酸: |
C.证明酸性条件下H2O2氧化性比I2强: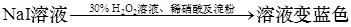 |
D.鉴定盐A的成分是FeBr2: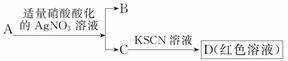 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
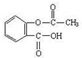 ),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: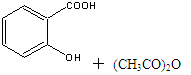

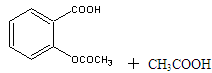

| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |

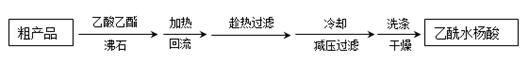
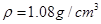 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
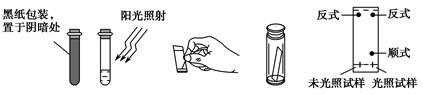
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com