
【题目】常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
【答案】D
【解析】A. 当V( NaOH )= 20mL时,H2A恰好与NaOH反应生成HA-,由图可知,此时溶液中n(H2A)>n(A2-),说明HA-的水解程度大于其电离程度,故溶液显碱性,pH>7,A不正确;B. 当V(NaOH)= 20mL时,结合图中信息可知,溶液中离子浓度大小关系为c(Na+)> c(HA-)> c(OH-)> c(H+)>c(A2-),B不正确;C. 当V(NaOH)= 10mL时,由物料守恒可知,2c(Na+)= c(HA-)+c(A2-)+c(H2A),C不正确;D. 当V(NaOH)= 30mL时,由电荷守恒c(H+)+c(Na+)= c(HA-)+2c(A2-)+ c(OH-)和物料守恒2c(Na+)= 3[c(HA-)+c(A2-)+c(H2A)],可以求得质子守恒式:2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-),D正确。本题选D。


科目:高中化学 来源: 题型:
【题目】中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。
(1)配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。
A.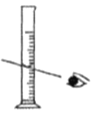 量取浓硫酸 B.
量取浓硫酸 B.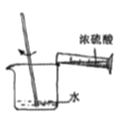 稀释浓硫酸 C.
稀释浓硫酸 C.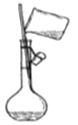 转移入容量瓶 D.
转移入容量瓶 D.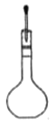 定容
定容
(2)浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:_______;当硫酸的浓度≥______mol/L时即具有脱水性。
(3)浓硫酸的强氧化性与浓度的关系
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
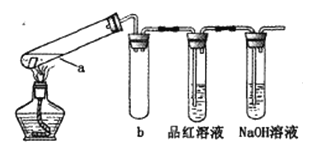
①b装置的作用是________
②本实验中证明浓硫酸具有强氧化性的现象是_________、________。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式____.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是_______.
(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物a、b的结构简式如图所示,下列说法正确的是

A. 化合物b不能使酸性高锰酸钾溶液褪色 B. a的消去产物中最多有15个碳原子共面
C. a、b均能发生还原反应、取代反应、消去反应 D. b分子发生加成反应最多消耗4mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】皮蛋是人们喜爱的食物,某同学查阅资料得知制作皮蛋的料泥中含有NaOH和Na2CO3,为检验其酸碱性,将料泥溶解过滤后,向滤液中加入
A. 稀硫酸 B. 酚酞试液 C. KNO3溶液 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
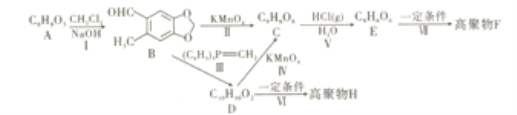
【题目】如图,现有芳香族化合物A,分子式为C8H8O3,含有两种官能团,A 的核磁共振氢谱存在6组峰。高聚物H不能降解,而高聚物F中含有六元环和八元环呈线性片状结构,并且可以降解。
已知:①酚羟基极易被氧化;
②—CHO+(C6H5)3P=CH一R→—CH=CH—R+(C6H5)3P = O;
③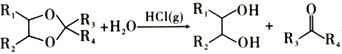 。
。
(1)化合物A中的官能团名称为_______________。反应(Ⅱ) (Ⅵ)的反应类型分别是_______________。
(2)化合物H的结构为____________________________。
(3)有同学提出可以将A 与KMnO4直接氧化反应得到E,请解释这样反应的不恰当之处。___________________________________________。
(4)反应(Ⅰ) 的化学方程式为________________________________,反应(Ⅶ) 的化学方程式为________________________________。
(5)满足下列条件的D的同分异构体有________________种。
A.含有苯环且苯环上只有两个取代基
B.含有酯基同时可以发生银镜反应
请写出核磁共振氢谱面积之比为1∶1∶2∶2∶4的化合物结构:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作名称是_____,该操作用到的玻璃仪器是_____
A.烧杯 B.漏斗 C.酒精灯 D.玻璃棒
(2)固体X是_____(填化学式),溶液Y是_____(填化学式)
(3)步骤2中发生反应的离子方程式为 _____ 。
(4)将回收的铜和一定浓度的稀硫酸混合后在加热的情况下通入氧气,发生反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
(5)步骤4中涉及的操作是:蒸发浓缩、___________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A. 电极a上发生的电极反应式为:H2S - 2e- = S+2H+
B. 电池工作时,电流从电极b经过负载流向电极a
C. 电路中每流过1 mol电子,电池内部释放158 kJ的热能
D. 每11.2 LH2S参与反应,有1 mol H+经固体电解质膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com