
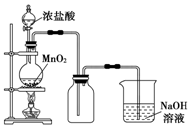
 实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应方程式:MnO2+4HCl( 浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl( 浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(2)随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,所以如果将过量二氧化锰与20mL 12mol•L-1的盐酸混合加热(忽略盐酸的挥发),充分反应后生成的氯气明显小于0.06mol;
故答案为:小于、随反应的进行,盐酸浓度变小,稀盐酸和二氧化锰不反应;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气,反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的制备和性质的检验,明确氯气制备的原理和氯气的性质是解题关键,注意二氧化锰只与浓盐酸反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| C. | 标准状况下,5.6L由CH4与C2H4组成的混合气体中含有的氢原子数目为6.02×1023 | |
| D. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3KJ,则其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
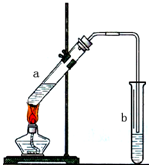 用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C6H14且含有三个甲基 | 2 |
| B | 分子式为C5H10,不能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,不能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2能与NaHCO3反应产生气体 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [M+]>[OH-]>[A-]>[H+] | B. | [M+]>[A-]>[H+]>[OH-] | C. | [M+]>[A-]>[OH-]>[H+] | D. | [M+]>[H+]=[A-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可加快该反应速率 | |
| B. | 升高温度能加快该反应速率 | |
| C. | 增大H2的浓度能加快该反应速率 | |
| D. | 密闭容器中,通入略过量的CO2可以实现H2的100%转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
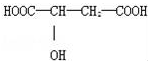 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 苹果酸在一定条件下能发生消去反应 | |
| D. | 苹果酸不能发生缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com