
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 乙酸乙酯 | 乙酸 | ||
| 4 | 乙醇 | 水 | ||
| 5 | 将重油转化为汽油 | |||
| 6 | 把煤转化为焦炉气、煤焦油和焦炭等 | |||
分析 乙烯与溴水反应,而乙烷不能;
溴与NaOH溶液反应后,与溴苯分层;
乙酸与碳酸钠溶液反应后,与乙酸乙酯分层;
水与CaO反应后,增大与乙醇的沸点差异;
将重油转化为汽油,需要发生裂化反应,将大分子转化为不饱和的小分子;
把煤转化为焦炉气、煤焦油和焦炭等,发生煤的干馏.
解答 解:乙烯与溴水反应,而乙烷不能,除杂试剂为溴水(A),分离方法为洗气(c);
溴与NaOH溶液反应后,与溴苯分层,则除杂试剂为NaOH溶液(B),分离方法为分液(b);
乙酸与碳酸钠溶液反应后,与乙酸乙酯分层,则除杂试剂为碳酸钠溶液(E),分离方法为分液(b);
水与CaO反应后,增大与乙醇的沸点差异,则除杂试剂为CaO(C),分离方法为蒸馏(a);
将重油转化为汽油,需要发生裂化反应,将大分子转化为不饱和的小分子,操作方法为g;
把煤转化为焦炉气、煤焦油和焦炭等,发生煤的干馏,操作方法为e,
故答案为:
| 组别 | 试剂 | 操作方法 |
| 1 | A | c |
| 2 | B | b |
| 3 | E | b |
| 4 | C | a |
| 5 | g | |
| 6 | e |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及分离方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 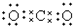 | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. | 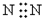 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和H2S | B. | O2和NH3 | C. | CO2和H2 | D. | CH4和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |
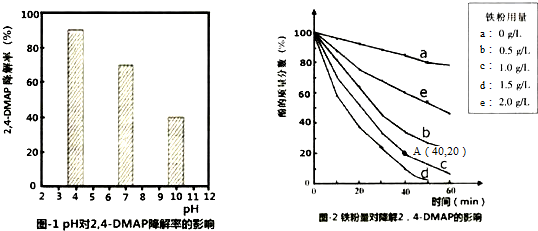
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com