

分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用苯或四氯化碳萃取,经蒸馏可得到碘,
(1)实验操作③由碘的水溶液得到碘的有机溶液,为萃取过程;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多;
(3)分离互溶液体通常采用蒸馏的方法.
解答 解:海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用苯或四氯化碳萃取,经蒸馏可得到碘,
(1)因为碘在有机溶剂中的溶解度比水大,且碘和有机溶剂易于分离,所以实验操作③为萃取分液,所用主要仪器名称为分液漏斗,故答案为:萃取分液;分液漏斗;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,从题给信息可知,酒精、甘油和水互溶,不能用作萃取剂,四氯化碳和苯与水互不相容,故可用四氯化碳或苯,故答案为:BD;
(3)互溶物质的分离采用蒸馏法,碘溶于有机溶剂中,所以有机溶液得到单质I2的方法为蒸馏,
故答案为:蒸馏.
点评 本题考查物质的分离和提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,学习中注意掌握过滤、萃取、蒸馏等操作,注意萃取剂选择的基本原则,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 四种元素均可与氢元素形成 18电子分子 | |
| B. | X、Y、Z、W形成的单质最多有 6种 | |
| C. | 四种元素中,Z的最高价氧化物对应水化物酸性最强 | |
| D. | 四种元素的原子半径:rZ>rX>rY>rW |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外围电子就是最外层电子 | |
| B. | 最外层电子数小于4的元素一定是金属元素 | |
| C. | 过渡元素的最外层电子数一般为1个或2个 | |
| D. | 如果某元素最外层电子数是1个或2个,次外层电子数为18个,此元素是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+和CH4 | B. | H3O+和NH3 | C. | NO3-和CO32- | D. | CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏时把温度计插入液面下 | |
| B. | 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制银镜 | |
| C. | 检验卤代烷中的卤素元素可先将卤代烷与NaOH溶液混合加热,然后加入AgNO3溶液,根据生成沉淀的颜色初步确定卤素 | |
| D. | 用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
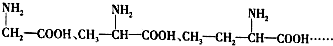
 ,B
,B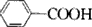 ,CCH2(NH2)COOH.
,CCH2(NH2)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com