
(6分)(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:阅读理解
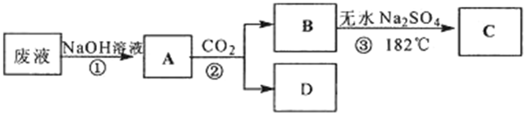
 +CO2+H2O→
+CO2+H2O→ +NaHCO3
+NaHCO3 +CO2+H2O→
+CO2+H2O→ +NaHCO3
+NaHCO3
|
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
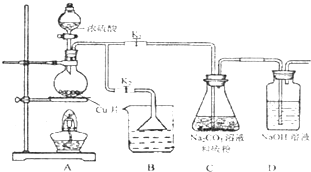 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
2- 7 |
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省哈三中高三10月月考化学试卷(带解析) 题型:填空题
(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号)。
①1mL 0.01 mol?L—1的碘水 ②1mL 0.001 mol?L—1的碘水
③4mL 0.01 mol?L—1的Na2S2O3溶液 ④4mL 0.001 mol?L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________。
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 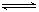 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
| | 0min | 5min | 10min |
| CO | 0.01 | | 0.0056 |
| H2O | 0.01 | | 0.0156 |
| CO2 | 0 | | 0.0044 |
| H2 | 0 | | 0.0044 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三10月月考化学试卷(解析版) 题型:填空题
(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号)。
①1mL 0.01 mol•L—1的碘水 ②1mL 0.001 mol•L—1的碘水
③4mL 0.01 mol•L—1的Na2S2O3溶液 ④4mL 0.001 mol•L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________。
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
|
|
0min |
5min |
10min |
|
CO |
0.01 |
|
0.0056 |
|
H2O |
0.01 |
|
0.0156 |
|
CO2 |
0 |
|
0.0044 |
|
H2 |
0 |
|
0.0044 |
(1) 请分别计算CO、H2O、CO2、H2的平衡浓度__________,_________,________,_______。
(2)CO的平衡转化率为____________,欲提高CO的转化率,下列措施中可行的是_____(填序号)。
a.增加压强 b.降低温度
c.体积不变,再充入CO d.更换催化剂
e.体积不变,再充入0.1molH2O
(3) 若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com