
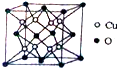
 铜是应用广泛的有色金属.
铜是应用广泛的有色金属.分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)Cu原子处于晶胞内部,O原子处于晶胞顶点与面心,利用均摊法计算晶胞中Cu原子、O原子数目,进而确定晶体的化学式;以上底面面心O原子研究,与之最近的Cu原子有8个,为晶胞中上层4个Cu原子,及面心氧原子所在另外晶胞中下层4个Cu原子;根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)Cu原子处于晶胞内部,O原子处于晶胞顶点与面心,晶胞中Cu原子数目为8、O原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶体的化学式为Cu2O;以上底面面心O原子研究,与之最近的Cu原子为晶胞中上层4个Cu原子,及面心氧原子所在另外晶胞中下层4个Cu原子,O原子配位数为8,晶胞中Cu原子数目为8、O原子数目为4,晶胞体积V=(a×10-10cm)3,则ρ=$\frac{m}{V}$=$\frac{(8×64+4×16)}{\frac{{N}_{A}}{(a×1{0}^{-10})^{3}}}$=
故答案为:Cu2O;8;$\frac{5.76×1{0}^{32}}{{N}_{A}×{a}^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布晶胞计算等,需要学生具备扎实的基础,难点是晶胞的计算,注意pm与cm之间的进制,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
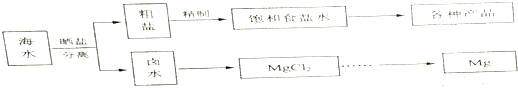
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③④⑤ | C. | ②⑤⑥⑦ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 观察比较外观形态 | B. | 用手触摸比较 | ||
| C. | 放到嘴里品尝一下 | D. | 用化学方法进行鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属之间只存在离子键 | |
| B. | 共价化合物里,一定存在极性键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 在离子化合物不可能存在非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 负极反应式:Ag+Cl-+e-═AgCl | |
| B. | Na+不断向“水”电池的正极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2COOH | B. | CH3CH(OH)COOH | C. | CH3OCH2COOH | D. | CH3CH(OH)CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com