
分析 (1)根据溴的原子的质子数为35,由能量最低原理来书写电子排布式;
(2)根据相对分子质量来判断范德华力,再比较物质的沸点;
(3)利用F的电负性及氢键来解释;
(4)根据价层电子对结构模型来分析I3+的空间构型;
(5)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,利用半径来分析晶格能相对较大的卤化物;
(6)非金属性越强,则对应最高价含氧酸的酸性就强,同种元素的含氧酸,利用非羟基氧个数来判断酸性.
解答 解:(1)溴的原子的质子数为35,核外电子数为35,由能量最低原理其电子排布式为[Ar]3d104s24p5,故答案为:[Ar]3d104s24p5;
(2)因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,即沸点BrI>ICl>Cl2 ,故答案为:BrI>ICl>Cl2 ;
(3)因F的电负性最大,则HF分子中存在氢键则形成二聚分子,故答案为:HF分子间形成氢键;
(4)因I3+可看成II2+,孤电子对数由$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(7-1-2×1)=2,σ键数为2,则I3+的空间构型为V形,故答案为:V形;
(5)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,则A为RbCl,故答案为:RbCl;
(6)因非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性到为②>③,故答案为:①②③.
点评 本题以卤素化学为信息来考查原子结构及物质的性质,明确沸点的比较方法、氢键对物质性质的影响、非金属性的比较、孤电子对数的确定是解答的关键,本题中(4)是解答的难点.


科目:高中化学 来源: 题型:多选题
| A. | A的相对分子质量比B的大16 | |
| B. | 该酯分子结构中一定存在双键 | |
| C. | B的相对分子质量比A大14 | |
| D. | 酯、A、B 3种分子中都含有一种相对分子质量大于60的相同基团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
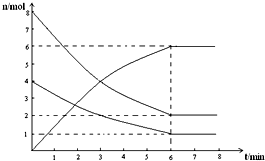 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:
在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
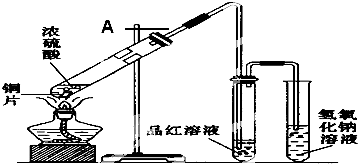
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com