
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO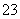 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10 mol·L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
答案 C
解析 等物质的量的NaHCO3和NaOH恰好反应生成Na2CO3,Na2CO3溶液中存在CO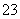 的水解平衡、H2O的电离平衡:CO
的水解平衡、H2O的电离平衡:CO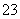 +H2O
+H2O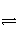
 HCO
HCO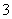 +OH-,H2O
+OH-,H2O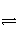
 H++OH-,因此A不正确;电荷守恒:c(Na+)+c(H+)=c(HCO
H++OH-,因此A不正确;电荷守恒:c(Na+)+c(H+)=c(HCO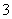 )+c(OH-)+2c(CO
)+c(OH-)+2c(CO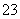 ),物料守恒:c(Na+)=
),物料守恒:c(Na+)=
c(HCO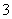 )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO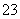 ),因此B不正确;C中CH3COOH和NaOH恰好反应生成CH3COONa和H2O,由于CH3COO-的水解,溶液呈碱性,因此C正确;由于CH3COOH为弱酸,不能完全电离,pH相同的HCl溶液和CH3COOH溶液,CH3COOH的浓度大于HCl的浓度,故中和相同体积、相同pH的HCl溶液与CH3COOH溶液,CH3COOH消耗的NaOH多,故D错误。
),因此B不正确;C中CH3COOH和NaOH恰好反应生成CH3COONa和H2O,由于CH3COO-的水解,溶液呈碱性,因此C正确;由于CH3COOH为弱酸,不能完全电离,pH相同的HCl溶液和CH3COOH溶液,CH3COOH的浓度大于HCl的浓度,故中和相同体积、相同pH的HCl溶液与CH3COOH溶液,CH3COOH消耗的NaOH多,故D错误。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
一定条件下在一容积恒为2L的容器内发生反应:2A(g) + B(g) 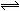 2C(g) ,已知起始投入4mol A(g) 和2mol B(g),经2s后测得C的浓度为0.6 mol/ L,并且2s后各组分浓度不再改变。下列说法正确的是
2C(g) ,已知起始投入4mol A(g) 和2mol B(g),经2s后测得C的浓度为0.6 mol/ L,并且2s后各组分浓度不再改变。下列说法正确的是
A.2s内用物质A表示的平均反应速率为0.3 mol/(L·s)
B.2s内用物质B表示的平均反应速率为0.6 mol/(L·s)
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.2s时物质B的浓度为0.7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
有如下合成路线,甲经二步转化为丙:
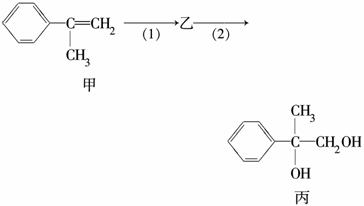
下列叙述错误的是( )
A.甲和丙均可与酸性KMnO4溶液发生反应
B.反应(1)的无机试剂是液溴,铁作催化剂
C.步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲
D.反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.按系统命名法,化合物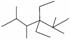 的名称是2,3,5,5四甲基4,4二乙基己烷
的名称是2,3,5,5四甲基4,4二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为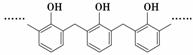 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
)Heck反应是合成C—C键的有效方法之一,如反应①:
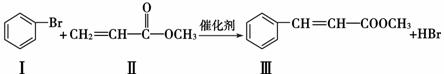
化合物Ⅱ可由以下合成路线获得:
Ⅳ(分子式C3H6O3)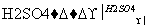 Ⅴ
Ⅴ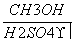 Ⅱ
Ⅱ
(1) 化合物Ⅲ的分子式为__________,1 mol化合物Ⅲ最多可与__________mol H2发生加成反应。
(2)化合物Ⅳ分子结构中有甲基,写出由化合物Ⅳ反应生成化合物Ⅴ的化学方程式
________________________________________________________________________
________________ ________________________________________________________。
________________________________________________________。
(3)有关化合物Ⅱ说法正确的 是( )
是( )
A.1 mol 化合物Ⅱ完全燃烧消耗5 mol O2
B.化合物Ⅱ能使酸性高锰酸钾溶液褪色
C.化合物Ⅱ难溶于水
D.化合物Ⅱ分子间聚合,反应生成的高聚物结构为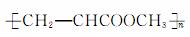
(4)化合物Ⅲ的一种同分异构体Ⅵ,苯环上的一氯取代物有两种,Ⅵ能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1∶1∶1∶3,Ⅵ的结构简式为________________________________________________________________________。
(5)CH3Ⅰ和O也可以发生类似反应①的反应,有机产物的结构简式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是________________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(填“>”、“<”或“=”)。
乙方案中,说明HA是弱电解质的现象是____________(多选扣分)。
①装HCl溶液的试管中放出H2的速率快;
②装HA溶液的试管中放出H2的速率快;
③两个试管中产生气体的速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处:
________________________________________________________________________、
________________________________________________________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: CH4(g) + H2O(g) = CO(g) + 3H2(g) △H= +206kJ/mol
CO(g) + H2O(g) = CO2(g) + H2(g) △H= -41 kJ/mol
C—H、H—O、H—H的键能分别为413 kJ/mol、463kJ/mol、436 kJ/mol,
则CO2中C=O的键能为
A.797.5 kJ/mol B. 682 kJ/mol C.572 kJ/mol D.483 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属的叙述中 ,正确的是
,正确的是 ()
()
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属与水 | |
| C. | 碱金属在空气中加热均可生成多种氧化物 | |
| D. | 碱金属的硬度小、密度小、熔点低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com