
【题目】由金属Na、Cu、C、N、B等元素组成的物质在生活和工业上有着广泛用途。
(1)基态Cu+的外围电子轨道式为_______。
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为_______;1个(HB=NH)3分子中含有 ___个σ键。
(3) B、C、N、O原子的第一电离能由大到小的顺序为_____________________。
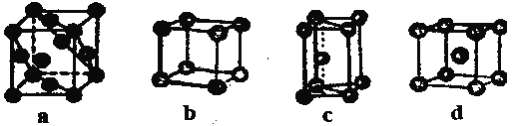
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为____(填字母)。
(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为____________。
【答案】 ![]() sp3 12 N>O>C>B d
sp3 12 N>O>C>B d ![]()
【解析】(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10,外围电子轨道式为![]() ,故答案为:
,故答案为: ![]() ;
;
(2)化合物H3BNH3中B原子与3个H原子和一个N原子相连接,价层电子对数=4,杂化方式为sp3;1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键.B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个,故答案为:sp3;12;
(3) B、C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C>B,故答案为:N>O>C>B;
(4)金属钠为体心立方结构,故选d;
(5)设晶胞边长为a,在NaCl晶胞中,含Cl-4个;含Na4个,根据密度公式ρ=![]() ,可得a=
,可得a=![]() ,所以晶胞面对角线长为
,所以晶胞面对角线长为![]() ×
×![]() ,而两个距离最近的氯离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的氯离子中心间的距离为
,而两个距离最近的氯离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的氯离子中心间的距离为![]() ×
×![]() ,故答案为:
,故答案为:![]() ×
×![]() 。
。


科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,是对大气中各种悬浮颗粒物含量超标的笼统表述,尤其是PM2.5(空气动力学当量直径小于等于2.5微米的颗粒物)被认为是造成雾霾天气的“元凶”。雾霾的化学成分较为复杂,包含有下列物质,其中属于有机化合物的是( )
A. 臭氧 B. 碳氢化合物 C. 氮氧化物 D. 一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B是周期表中同主族相邻的两元素,A、B所在周期分别有a、b种元素。若A的原子序数为x,则B的原子序数可能为
①x+a ②x-a ③x+b ④x-b
A. ①③ B. ①④ C. ②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的叙述中,正确的是( )
A. 单质、共价化合物、离子化合物中都存在共价键
B. 金属和非金属所形成的化学键均为离子键
C. 阴、阳离子通过静电引力而形成的化学键叫做离子键
D. 共价化合物中一定不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2的催化氧化是硫酸工业的主要反应之一。现有标准状态下22.4LSO2气体,在500℃、V2O5催化下转化为SO3,若SO2的转化率为50%,放出热量为QKJ,则该反应的热化学方程式为____________.
(2)已知在SO2催化氧化前后混合气体中各成分的体积分数如图,则SO2的转化率为_______________。

(3)恒温、恒压下,在一个容积可变的密闭容器中发生:A(g)+ 2B(g)![]() C(g);开始加入3molA和5molB,体系体积为V升,平衡时可生成amolC,同样条件下,要使平衡时生成C为3.5amol,则开始时除加入5.5molB还需加入___________molA和_________molC。
C(g);开始加入3molA和5molB,体系体积为V升,平衡时可生成amolC,同样条件下,要使平衡时生成C为3.5amol,则开始时除加入5.5molB还需加入___________molA和_________molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子和Y元素的阴离子具有与氩相同的电子层结构,下列叙述正确的是
A. X的原子序数比Y小 B. X原子的最外层电子数比Y小
C. X的原子半径比Y小 D. X元素的最高正价比Y大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对原子结构的认识顺序正确的是( )
①道尔顿原子模型;②卢瑟福原子模型;③波尔原子轨道模型;④汤姆生原子模型
A.①②③④B.①③②④C.①④②③D.④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数c>b B. 离子还原性Y2->Z-
C. 氢化物稳定性H2Y>HZ D. 原子半径X<W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com