
| A. | 钢铁设备与直流电源正极相连可防腐 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫不能用勒夏特列原理解释 | |
| D. | 废旧电池中的汞、锅、铅等重金属盐对土壤和水源会造成污染 |
分析 A.电解池的阳极金属容易被腐蚀,阴极金属被保护;
B.明矾在溶液中电离出铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水;
C.开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对化学平衡的影响导致的,且存在可逆反应,能用勒夏特列原理解释;
D.汞、锅、铅等重金属盐有毒;
解答 解:A.钢铁设备与直流电源正极相连,则形成电解池,为电解池阳极,加快防腐速率,故A错误;
B.明矾在溶液中电离出铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,但不能杀菌消毒,故B错误;
C.开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对化学平衡的影响导致的,且存在可逆反应,能用勒夏特列原理解释,故C错误;
D.重金属盐有毒,则废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染,应集中回收处理,故D正确;
故选:D.
点评 本题为综合题,涉及金属的腐蚀与防护、明矾净水原理、化学平衡移动理论、环境污染与保护,明确电解池工作原理、盐类水解规律是解题关键,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | P4和NO2都是共价化合物 | |
| B. | CCl4和NH3都是以极性键结合的极性分子 | |
| C. | H2O2的分子是含有极性键的非极性分子 | |
| D. | 在SiC和SiO2晶体中,都不存在单个小分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
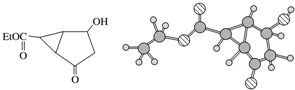
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H10O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 互为同分异构体且属于芳香烃的分子的结构简式:
互为同分异构体且属于芳香烃的分子的结构简式: ;
;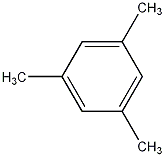 、
、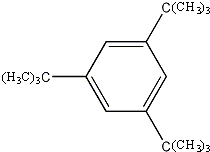 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,78 g 固体Na2O2中,含有的阴阳离子总数为4 NA | |
| B. | 标准状况下,4.48L HF分子中含0.2NA个H-F键 | |
| C. | 常温常压下,8gO2含有8NA个电子 | |
| D. | 4℃时,20 g 2H216O中含有共用电子对数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中Na的金属性最强 | B. | 原子半径Na>O,离子半径O2->Na+ | ||
| C. | 同族元素中O的氢化物稳定性最高 | D. | 同族元素中Cl的氢化物沸点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com