
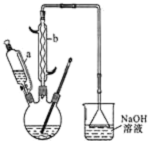
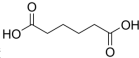
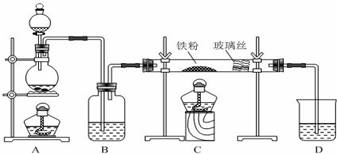
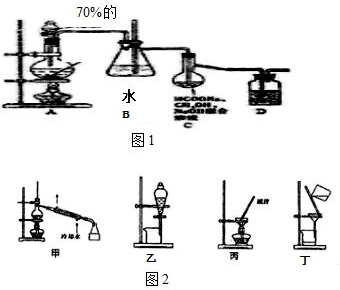
 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图: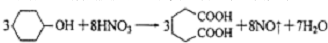
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
分析 (1)依据仪器的构造可知:仪器b的名称为:球形冷凝管(或冷凝管),冷凝管起冷凝作用;
(2)环己醇的滴入速率过快,反应过快,该反应放热,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中;
(3)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,据此写反应的化学方程式;
(4)产品己二酸中含有环己醇、硝酸等杂质,根据己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯分析;
(5)粗产品依据溶解度差别,可以通过重结晶可以提纯;依据反应的环己醇为5.4mL,质量=5.4ml×0.962g/ml=5.1948g,结合化学方程式计算理论上上城己二酸的质量,产率=$\frac{实际产量}{理论产量}$×100%;
解答 解:(1)该仪器有球形区域,仪器b的名称为:球形冷凝管(或冷凝管),冷水从冷凝管下口入,上口出,克服重力充满冷凝管,冷凝效果好,
故答案为:球形冷凝管(或冷凝管);
(2)向三口烧瓶中滴加环己醇时,反应温度迅速上升,说明该反应为放热反应,需控制好环己醇的滴入速率,如果环己醇的滴入速率过快,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中,
故答案为:反应液暴沸冲出冷凝管;放热过多可能引起爆炸,产生的二氧化氮气体来不及被碱液吸收而外逸到空气中;
(3)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,反应的化学方程式为①NO+NO2+Na2CO3═2NaNO2+CO2,②Na2CO3+2NO2═NaNO2+NaNO3+CO2,
故答案为:2NO2+Na2CO3═NaNO2+NaNO3+CO2,NO+NO2+Na2CO3═2NaNO2+CO2;
(4)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,温度高溶解度大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,最后用苯洗涤晶体,除去表面的杂质,避免产品损失,
故答案为:苯;
(5)粗产品再溶解,再结晶析出,通过重结晶的方法提纯己二酸,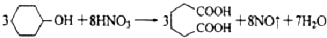
3×100 3×146
5.1948g m
m=7.58g
己二酸产率=$\frac{5.7g}{7.58g}$×100%=75%,
故答案为:重结晶;75%.
点评 本题考查实验室合成己二酸,涉及仪器识别、物质的分离与提纯、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
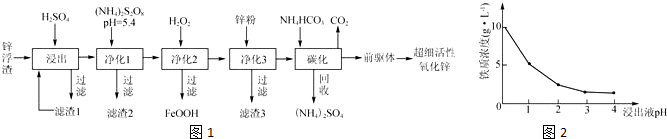
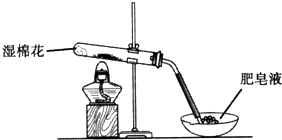 某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.
某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
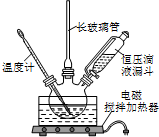 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图: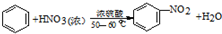
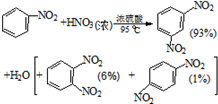
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |
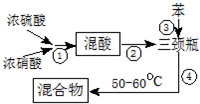

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
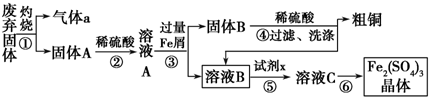
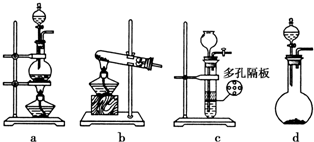
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知乙酸和乙醇在浓硫酸催化下会发生下列反应:
已知乙酸和乙醇在浓硫酸催化下会发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快KClO3的分解速率,加入MnO2 | |
| D. | 为提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com