
分析 (1)根据溶液稀释过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
(2)根据配制一定物质的量浓度的溶液一般步骤选择需要的仪器;
(3)依据量筒、容量瓶使用方法及注意事项,定容的正确操作解答;
(4)A.使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大;
C.容量瓶不能用来稀释浓溶液;
D.容量瓶不能用来溶解固体;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)设需要浓硫酸体积为V,则根据溶液稀释过程中溶质硫酸的物质的量不变得:18mol/L×V=0.2mol•L-1×500mL,解得V=5.6mL;
故答案为:5.6mL;
(2)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等用到的仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,量取5.6mL浓硫酸应选择10mL量筒,配制500mL浓硫酸,应选择500mL烧杯、500mL容量瓶,所以用到的仪器:ACEI,还缺少的仪器:胶头滴管;
故答案为:ACEI;胶头滴管;
(3)①用量筒量取计算所需的浓硫酸体积,操作正确,故不选;
②量取液体后量筒不能用蒸馏水洗涤,操作错误,故选;
③浓硫酸稀释过程产生大量的热,应冷却后将稀释后的溶液转入容量瓶中,操作错误,故选;
④然后小心地往容量瓶中加蒸馏水至离刻度线1-2cm,改用胶头滴管逐滴滴加到液面最低处与刻度线相切,操作错误,故选;
⑤把容量瓶盖盖紧,再振荡摇匀,操作正确,故不选;
故选:②③④;
(4)A.使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大,故B错误;
C.容量瓶不能用来稀释浓溶液,应先在烧杯中稀释,冷却后再转移到容量瓶,故C错误;
D.容量瓶不能用来溶解固体,应先在烧杯中溶解,冷却后再转移到容量瓶,故D错误;
故选:CD;
(5)A.量取浓硫酸的量筒使用后,用水洗净并将洗涤液一并倒入容量瓶中,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高,
故答案为:偏高;
B.定容时,俯视液面最凹面与刻度线相平,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
C.摇匀后,发现液面低于刻度线后,继续加水至液面最凹面与刻度线相平,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;
D.所用浓硫酸,已在空气中放置较长时间,浓硫酸浓度降低,量取的浓硫酸中含有硫酸的物质的量偏小,溶液浓度偏低;
故答案为:偏低;
E.配制溶液前,容量瓶中已有少量水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
故答案为:不变.
点评 本题考查了用容量瓶配制一定物质的量浓度溶液的实验操作和注意事项,明确配制原理及操作步骤是解题关键,注意误差分析的方法,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.
某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
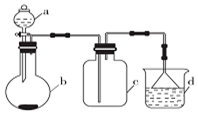 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | NH3 | H3O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石的熔化和冰的融化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
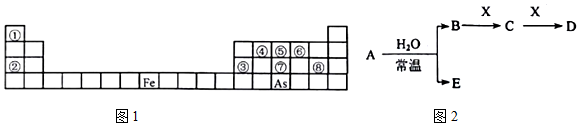
 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
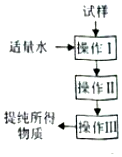 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com