
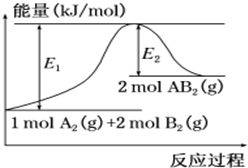
 已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
分析 化学反应A2(g)+2B2(g)═2AB2(g)的能量变化依据图象分析,结合反应前后能量守恒可知,反应物能量之和小于生成物的能量之和,反应是吸热反应,反应过程中断裂化学键需要吸收能量,形成化学键放出热量,据此分析.
解答 解:A.反应前后能量守恒可知,反应物能量之和小于生成物的能量之和,反应是吸热反应,吸热反应不一定都要加热,例如氢氧化钡和氯化铵在常温下就反应,故A错误;
B.该反应焓变=断裂化学键吸收热量-形成化学键所放出热量,所以焓变为△H=+(E1-E2)kJ/mol,故B错误;
C.反应是吸热反应,依据能量守恒可知,即反应物的键能总和大于生成物的键能总和,故C正确;
D.断裂化学键吸收热量,所以断裂1 mol A-A和2 mol B-B吸收E1 kJ能量,故D错误;
故选C.
点评 本题考查了反应热量变化的分析判断,图象分析,反应前后的能量守恒应用,化学键的断裂和形成与能量的关系,计算焓变的依据,题目较简单,试题有利于培养学生的分析、理解能力及化学计算能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ②③ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com