
| A. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| B. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
分析 A.甲苯与高锰酸钾反应,苯与高锰酸钾不反应;
B.苯不与溴水反应,制取溴苯应该用液溴;
C.浓硫酸缓缓注入到浓硝酸中,最后加苯;
D.制备氢氧化铜浊液时,加入的氢氧化钠必须过量.
解答 解:A.甲苯与高锰酸钾反应,能使高锰酸钾溶液褪色,苯与高锰酸钾溶液不反应,可鉴别甲苯和苯,故A正确;
B.制取溴苯的原料为:铁屑、液溴和苯,苯与溴水不反应,故B错误;
C.实验室制取硝基苯时,应该把浓硫酸缓缓注入到浓硝酸中并及时搅拌冷却,最后逐滴加入苯,边加边振荡,使混酸与苯混合均匀,故C错误;
D.用新制氢氧化铜悬浊液检验醛基时,必须是在碱性条件下,该实验中NaOH不足导致NaOH和硫酸铜混合溶液不是碱性,所以实验不成功,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及常见有机物制备、物质检验与鉴别、官能团检验等知识点,明确实验原理、物质性质及其性质差异性是解本题关键,侧重考查学生分析判断能力,易错选项是D.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5 a L | B. | a L | C. | 2 a L | D. | 3 a L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
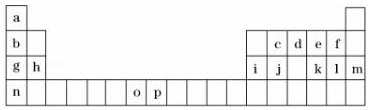
| 元素 | O | P | |
| 电离能/KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
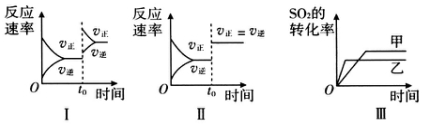
| A. | 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 | |
| C. | 图Ⅱ研究的是t0时刻加入催化剂对化学平衡的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任意位置寻找 | B. | 稀有气体元素中寻找 | ||
| C. | 金属和非金属的分界线处寻找 | D. | 活泼金属和活泼非金属区中寻找 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com