
| A. | 2倍 | B. | 1.5倍 | C. | 0.9倍 | D. | 0.5倍 |
分析 发生反应为 2SO2+O2?2SO3,根据反应利用差量法计算出反应后气体的物质的量,然后根据密闭容器内压强之比等于物质的量之比进行计算.
解答 解:2SO2+O2?2SO3 △n(减少)
2 1 2 1
2 mol 1mol,
根据分析可知,反应后气体物质的量为:5mol:5mol-1mol=9mol,
容器容积不变时,容器内压强与气体的物质的量成正比,则此时密闭容器内压强是反应前压强的$\frac{9mol}{5mol+5mol}$=0.9倍,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
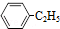 (g)?
(g)?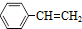 (g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:
(g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20min的平均速率为v(H2)=0.008mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol•L-1,则a<0 | |
| C. | 保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,再次达到平衡时乙苯的转化率小于50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH | B. | CH3COOH | C. | C2H5OH | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是σ键,没有π键 | B. | 都是π键,没有σ键 | C. | 既有π键,又有σ键 | D. | 除CH4外,都是σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | 1mol的1H35Cl分子所含中子数为18个 | |
| C. | 7g的35Cl2气体的体积为2.24L | |
| D. | 35Cl2气体的摩尔质量为70g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com