
| A. | 钢铁腐蚀 | B. | 游泳池加漂白精消毒 | ||
| C. | 防毒面具中加Na2O2供氧 | D. | 纯碱去油污 |
分析 氧化还原反应的特征是元素化合价的升降,如发生氧化还原反应,应存在元素化合价的变化,结合对应物质的性质解答该题.
解答 解:A、钢铁腐蚀,铁由单质变成化合物,是氧化还原反应,故A正确;
B、漂白粉易生成具有强氧化性的次氯酸,可用于杀菌消毒,所以用漂白粉消毒游泳池利用了物质的氧化性,故B正确;
C、防毒面具中加Na2O2供氧,是过氧化钠与二氧化碳反应生成氧气单质,是氧化还原反应,故C正确;
D、纯碱去油污,纯碱水解显碱性,油脂在碱性条件下水解,没有发生氧化还原反应,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 | |
| B. | 去皮苹果放在空气中久置变黄与纸张久置变黄原理相似 | |
| C. | 高纯硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| D. | 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | a=0.05 | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
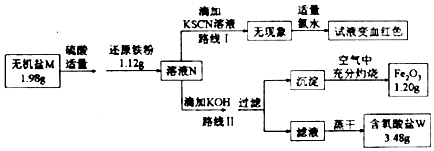
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  | 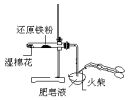 | 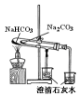 |
| 验证:溶解性AgCl>AgBr>Ag2S | 验证:非金属性Cl>C>Si | 验证:铁粉与水蒸气反应产生的氢气 | 验证:热稳定性 Na2CO3>NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
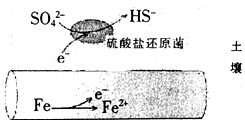 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )| A. | 正极反应为:SO42-+5H2O+8e-=HS-+9OH- | |
| B. | 输送暖气的管道不易发生此类腐蚀 | |
| C. | 这种情况下,Fe腐蚀的最终产物为Fe2O3•xH2O | |
| D. | 管道上刷富锌油漆可以延缓管道的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com