
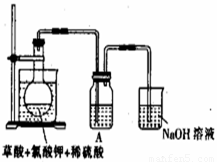
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景。某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)

已知信息:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃。与碱反应和氯气相似。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
(1)制备ClO2的化学方程式:2KClO3+H2C2O4= 2KHCO3+2ClO2↑;下列说法正确的是
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中失去电子
D.1mol KClO3参加反应有2mol电子转移
(2)A装置中还缺少的一样仪器名称是__________,
若将A中烧杯去掉,让烧瓶直接加热是否可以,为什么?_________________________。
(3)C装置吸收尾气后,溶液中含有NaOH、Na2CO3等溶质,该同学认为C中还可能含有NaClO2、NaClO3,试分析可能的原因,并写出有关化学方程式 ________ 。
(4)实验室还可通过以下反应制得ClO2:
KClO3+ H2C2O4+ H2SO4= ClO2↑+ K2SO4+ CO2↑+ H2O.
配平上述方程式。0.5 mol KClO3参加反应有 个电子转移。
(1)AC (2)温度计;不可以,若直接加热温度难以控制。(3)ClO2挥发,进入C中,与氢氧化钠溶液反应。2ClO2+2NaOH= NaClO2 +NaClO3+H2O
(4)2KClO3+H2C2O4+H2SO4= 2ClO2↑+K2 SO4+2CO2↑+2H2O3.01×1023 (或0.5NA)
【解析】
试题分析:(1)反应2KClO3+H2C2O4= 2KHCO3+2ClO2↑中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,A、KClO3中Cl元素的化合价由+5价降低为+4价,则在反应中得到电子,正确;B、KClO3中Cl元素的化合价由+5价降低为+4价,被还原生成ClO2,ClO2为还原产物,错误;C、H2C2O4中C元素的化合价由+3价升高到+4价,草酸为还原剂,正确;D、1molKClO3参加反应转移电子为1mol,错误。(2)制备ClO2气体的反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,必须控制温度在60℃,采用水浴加热,应用温度计则水温;(3)由信息①知ClO2的沸点11.0℃,易挥发,与碱反应和氯气相似可得:2ClO2+2NaOH= NaClO2 +NaClO3+H2O(4)利用化合价升降法配平氧化还原方程式;KClO3中Cl元素的化合价由+5价降低为+4价,1mol KClO3参加反应转移电子为1mol,0.5 mol KClO3参加反应有0.5NA个电子转移。
考点:考查氧化还原反应基本概念,化学方程式的书写及有关实验。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:阅读理解
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子()。饮用水中ClO2、
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使将溶液中的
还原为
以测定其含量,该反应的离子方程式为:
④若饮用水中的含量超标,可向其中加入适量的
将
还原为
,则该反应的氧化产物为 (填化学式)
查看答案和解析>>
科目:高中化学 来源:2010年河南省唐河三高高二下学期期末考试化学试题 题型:实验题
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
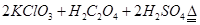
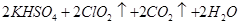
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(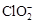 )。饮用水中ClO2、
)。饮用水中ClO2、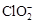 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使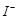 将溶液中的
将溶液中的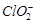 还原为
还原为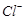 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中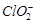 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的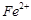 将
将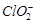 还原为
还原为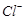 ,则该反应的氧化产物为
(填化学式)
,则该反应的氧化产物为
(填化学式)
查看答案和解析>>
科目:高中化学 来源:09-10年新余一中高二下学期第二次段考化学卷 题型:实验题
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。

(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为


①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(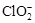 )。饮用水中ClO2、
)。饮用水中ClO2、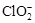 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的 将
将 还原为
还原为 ,则该反应的氧化产物为
(填化学式)
,则该反应的氧化产物为
(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景。某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)
已知信息:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃。与碱反应和氯气相似。
 ②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
(1)制备ClO2的化学方程式:
2KClO3+H2C2O4==== 2KHCO3+2ClO2↑;
下列说法正确的是
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中失去电子
D.1mol KClO3参加反应有2mol电子转移
(2)A装置中还缺少的一样仪器名称是__________,
若将A中烧杯去掉,让烧瓶直接加热是否可以,为什么?_________________________。
(3)C装置吸收尾气后,溶液中含有NaOH、Na2CO3等溶质,该同学认为C中还可能含有
NaClO2、NaClO3,试分析可能的原因,并写出有关化学方程式 ________
。
(4)实验室还可通过以下反应制得ClO2:
KClO3+ H2C2O4+ H2SO4==== ClO2↑+ K2SO4+ CO2↑+ H2O.
配平上述方程式。
0.5 mol KClO3参加反应有 个电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com