
蒸馏、分馏和干馏是化工生产的三种生产工艺,下列有关说法正确的是
A.三种工艺均需采用加热和冷却装置
B.实验室中进行这三种操作时均需在烧瓶中进行
C.三种工艺均是物理变化过程
D.三种工艺均是化学变化过程
科目:高中化学 来源:2015-2016学年海南省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列物质,既含离子键又含共价键的是
A.Na2S B.NH3 C.MgCl2 D.NaOH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和甘油 ③溴化钠和单质溴的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是( )
A. 分液、萃取、蒸馏、萃取 B. 萃取、蒸馏、分液、萃取
C. 分液、蒸馏、萃取、蒸馏 D. 蒸馏、萃取、分液、萃取
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的电子层结构。下列说法不正确的是
A. X是钠元素
B. 离子半径:r(X+)>r(Z2-)
C. 同主族元素中Z的氢化物热稳定性最强
D. 同周期元素中Y的非金属性最强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省怀化市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列物质中,属于共价化合物的是
A.H2 B.HCl C.NaCl D.NaOH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省怀化市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列措施不利于改善湖南地区环境质量的是
A.回收废电池
B.使用太阳能热水器
C.使用不易降解的塑料餐具
D.推广使用清洁燃料的公交车
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
关于如图所示转化关系(X代表卤素),说法正确的是
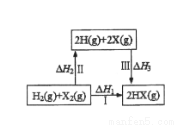
A.H2(g)+X2(g)=2H(g)+2X(g);△H2>0
B.生成HX的反应热与途径有关,所以△H1≠△H2+△H3
C.若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多
D.△H1代表H2的燃烧热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:填空题
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气的主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_____________________________(填元素符号)。
(3)元素的非金属性Z____Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊 |
B.Z与Q之间形成的化合物中元素的化合价 |
C.Z和Q的单质的状态 |
D.Z和Q在周期表中的位置 |
(4)X与Y可形成简单分子A,写出A的电子式_______________;实验室制备气体A的化学方程式 。
【答案】(1)第三周期第VIA族 (2)Na>S>N>O>H
(3)> ;C;(4) 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
【解析】试题分析:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Z处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y的氧化物是形成酸雨的主要物质之一,结合(5)中X与Y可形成分子,也可形成阳离子,则Y为N元素。(1)Q为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期ⅥA族;(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>S>N>O>H;(3)O、S同主族自上而下非金属性减弱,故非金属性O>S;a.H2S的水溶液放置在空气中会变浑浊,说明氧气能氧化硫化氢生成硫,则氧气的氧化性大于S,说明O元素非金属较强,正确;b.S与O元素形成的化合物中S元素表现正化合价,O元素表现负化合价,氧原子对键合电子吸引力更大,氧元素非极性较强,正确;c.单质状态属于物理性质,不能比较非金属性强弱,错误;d.同主族自上而下非金属性减弱,故非金属性O>S,正确,(4)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,A为NH3,电子式为 ,在实验室是用NH4Cl和Ca(OH)2混合加热制取氨气,反应的化学方程式是:2NH4Cl+Ca(OH)2
,在实验室是用NH4Cl和Ca(OH)2混合加热制取氨气,反应的化学方程式是:2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
考点:考查元素化合物推断、物质结构与性质机元素在周期表的位置关系应用的知识。
【题型】推断题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)830℃,在1L的固定容器的密闭容器中放入1 mol CO和5 mol H2O,反应达平衡后,其化学平衡常数K 1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡 移动。(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com