
19分)实验室欲用胆矾配制250 mL0.2 mol·L-1的CuSO4溶液。
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A 计算B 称量 C.溶解D.______E. ______F. 定容 G. 摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒还有______
和______ (填仪器名称)
(3)经计算需要称取CuSO4·5H2O的质量为______ 。
(4)若称取胆矾时砝码被放在左盘(10g以下用游码),则配制的CuSO4溶液的浓度______ (填“偏高”、“偏低”、“无影响”);若定容时仰视刻度线,则配制的CuSO4溶液的浓度______ (填“偏高”、“偏低”、“无影响”)。
(5)从准确配制好的CuSO4溶液中取出50mL ,则这50mL CuSO4溶液的物质的量浓度为______________,所含Cu2+的质量为。
(1)D. 转移 E.洗涤(2) 250 mL容量瓶、胶头滴管(3)12.5g (4)偏低;偏低(5)0.2 mol·L-10.64g
解析试题解析:(1)配制步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等;(2)根据各步操作需要,还需用到的仪器是250mL容量瓶、胶头滴管;(3)n=cV=0.25L×0.2mol/L=0.05mol,m=nM=250g/mol×0.05mol=12.5g;(4)称量固体质量时物码倒置使m偏低,则n偏低,由c=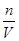 知,浓度偏低;定容时仰视刻度线仰视刻度线使V偏高,由c=
知,浓度偏低;定容时仰视刻度线仰视刻度线使V偏高,由c=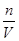 知,浓度偏低;(5)溶液浓度与体积无关,故该50ml溶液的浓度为0.2 mol·L-1;n=cV=0.05L×0.2mol/L=0.01mol,m=nM=64g/mol×0.01mol=0.64g。
知,浓度偏低;(5)溶液浓度与体积无关,故该50ml溶液的浓度为0.2 mol·L-1;n=cV=0.05L×0.2mol/L=0.01mol,m=nM=64g/mol×0.01mol=0.64g。
考点:一定物质的量浓度溶液的配制


科目:高中化学 来源: 题型:单选题
化学与环境、材料、信息、能关系密切,下列说法正确的是
| A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B.绿色化学的核心是利用化学原理治理环境污染 |
| C.将煤气化或液化,获得清洁燃料 |
| D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 +16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是 。
(3)KMnO4的氧化性比Cl2的氧化性 (选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为 L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、 。
②应用托盘天平称取KMnO4固体 g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) 。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下:
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将沿烧杯内壁慢慢注入盛有少量的烧杯中; |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室需要配制480 mL 0.4 mol/L的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解,②把①所得溶液小心转入一定容积的容量瓶中,③继续向容量瓶中加蒸馏水至液面距刻度线1—2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切,④用少量蒸馏水洗涤烧杯和玻璃棒2—3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀,⑤将容量瓶瓶塞塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为 (填序号)。
(2)本实验应选用 mL的容量瓶,应称取NaCl晶体的质量为 。
(3)误差分析(填“偏高”、“偏低”、“无影响”):
①称量NaCl晶体时,物码放反(1 g以下用游码) ,②定容时俯刻度线 ,
③没有进行操作步骤④ ,④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出 ,⑤容量瓶中原来有少量蒸馏水 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
①所需浓H2SO4的体积为________。
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________ mL量筒最好。
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的烧杯里,并不断搅拌,目的是_______ 。
④加水至液面接近刻度线1-2cm时,改用________加水,使溶液的凹液面正好跟刻度线相平。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①定容时观察液面俯视:________;②NaOH颗粒表面部分变质:________。
(3)Fe(OH)3胶体的制备方法为:
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(7分)暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)3.96 g化合物A中含有Fe元素的物质的量为 mol,含有钾元素的物质的量为 mol。化合物A的化学式为 ;
(2)化合物A与H2O反应的离子方程式为 。
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应原理不符合工业冶炼金属实际情况的是
A.2HgO 2Hg+O2↑ 2Hg+O2↑ |
B.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
C.2MgO(熔融) 2Mg+O2↑ 2Mg+O2↑ |
D.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(8分)现有A-G七种物质,已知A是赤铁矿的主要成分,E是浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系。
(1)写出下列物质的化学式;E: ,D: .
(2)在反应①②③中,属于置换反应的是 (填序号)。
(3)工业上常利用反应①的原理练铁,写出反应①的化学方程式 。
(4)写出物质C与E的稀溶液发生反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com