
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
分析 A、亚铁离子和碘离子均能与氯气反应;
B、丙烯和环丙烷的摩尔质量均为42g/mol;
C、在硫酸钾溶液中,阴离子除了硫酸根,还有氢氧根;
D、过氧化钠是由2个钠离子和1个过氧根构成的.
解答 解:A、亚铁离子和碘离子均能与氯气反应,故1molFeI2与足量氯气反应时能转移3mol电子即3NA个,故A错误;
B、丙烯和环丙烷的摩尔质量均为42g/mol,故42g混合物的物质的量为1mol,而两者的分子式均为C3H6,故1mol混合物中含6mol氢原子即6NA个,故B正确;
C、在硫酸钾溶液中,阴离子除了硫酸根,还有氢氧根,故溶液中的阴离子所带的负电荷大于2NA个,故错误;
D、过氧化钠是由2个钠离子和1个过氧根构成的,故1mol过氧化钠中含3mol离子即3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题

 ,写出B的化学式:Fe3O4,写出C的化学式:Al2O3,主要成分是J的矿石的名称:赤铁矿.
,写出B的化学式:Fe3O4,写出C的化学式:Al2O3,主要成分是J的矿石的名称:赤铁矿.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=8的碱性溶液中不可能存在H2CO3分子 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 0.1mol/LCH3COOH溶液加水稀释,溶液的pH和CH3COOH的电离度均增大 | |
| D. | 将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色褪去,说明BaCl2溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
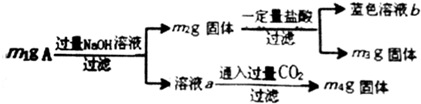
| A. | 由m1、m2、m4可计算出混合物中Al、Al2O3的物质的量 | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 蓝色溶液中一定有Cu2+、Fe2+、Fe3+ | |
| D. | 当m2-m3=2.96g时,Fe3O4的质量至少为2.32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | HCO3- | C. | Na+ | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
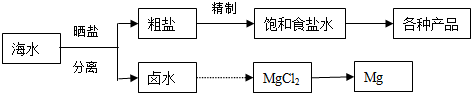
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
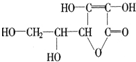
| A. | 是一个环状的酯类化合物 | B. | 易起加成及氧化反应 | ||
| C. | 可以溶解于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
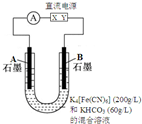 气态废弃物中的硫化氢可用下法转化为可利用的硫.
气态废弃物中的硫化氢可用下法转化为可利用的硫.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com