
| A. | 它们的原子核外电子层数随核电荷数的增多而增多 | |
| B. | 单质的颜色随核电荷数的增多而加深 | |
| C. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增多而增强 |
分析 A.从F、Cl、Br、I,它们的原子核外电子层数 随着核电荷数增多而增多;
B.F、Cl、Br、I元素单质的颜色分别是淡黄绿色、黄绿色、深红棕色、紫黑色;
C.元素的非金属性越强,其单质的氧化性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.F、Cl、Br、I原子核外电子层数分别为2、3、4、5,原子核外电子层数随核电荷数的增加而增多,故A正确;
B.F、Cl、Br、I元素单质的颜色分别是淡黄绿色、黄绿色、深红棕色、紫黑色,所以单质的颜色随核电荷数的增多而加深,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,F、Cl、Br、I的非金属性逐渐减弱,其单质的氧化性逐渐减弱,所以被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,F、Cl、Br、I的非金属性逐渐减弱,所以其氢化物的稳定性随核电荷数的增多而减弱,故D错误;
故选D.
点评 本题考查同一主族元素性质递变规律,侧重考查学生判断及知识运用能力,知道同一周期、同一主族元素原子结构及元素性质递变规律,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化硼是原子晶体 | |
| B. | 熔化时,氯化硼能导电 | |
| C. | 氯化硼是一种离子晶体 | |
| D. | 水解方程式:BCl3+3H2O?H3BO3+3HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率高 | |
| C. | t1至t2时刻该反应的速率为3mol•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
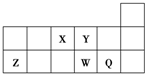
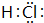 ,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.
,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 稀氨水中加入氢氧化化钠固体少量,由于氨水的电离平衡逆向移动,所以溶液的碱性减弱 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}COO)}$ 的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
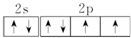 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4 mol/L | B. | SO2为0.3 mol/L、SO3为0.3 mol/L | ||
| C. | SO2为0.25 mol/L | D. | O2为0.05 mol/L、SO3为0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com