
【题目】食品防腐剂R的结构简式如图所示: ,下列说法正确的是
,下列说法正确的是
A.R在空气中易被氧化且易溶于水
B.1个R分子最多有20个原子共平面
C.能与FeCl3发生显色反应,苯环有2个取代基,且能发生水解反应R的同分异构体有18种(包括R)
D.1molR与3molH2反应生成的有机物分子式为C9H18O3
【答案】C
【解析】
A.R结构中含有酚羟基,容易被空气中的氧气氧化,但酚和酯常温下在水中的溶解度均较小,故A错误;
B.苯环上所有原子共平面,-OH中原子共平面,酯基为平面结构,单键可以旋转,则该分子中羟基上所有原子、苯环上所有原子、酯基上所有原子、亚甲基上的碳原子和1个氢原子以及甲基上的碳原子和1个氢原子可能共平面,所以最多有19个原子共平面,故B错误;
C.能与FeCl3发生显色反应,说明含有酚羟基,苯环上含有2个取代基,且能发生水解反应R的同分异构体中还含有酯基,则另一个取代基可能为—COOCH2CH3、—CH2COOCH3、—OOCCH2CH3、—CH2OOCCH3、—CH2CH2OOCH、—CH(CH3)OOCH,每两个取代基均存在邻位、间位和对位,共18种(包括R),故C正确;
D.R的分子式为C9H10O3,只有苯环能和氢气发生加成反应,则1molR与3 molH2反应生成的有机物分子式为C9H16O3,故D错误;
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________,Ag+的价电子排布式为_________。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ/mol | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。
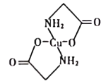
①配合物中碳原子的轨道杂化类型为_________。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________个;该晶体的化学式为_________。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为_________pm(1pm=10-12m,只写计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选相应实验目的填入下述括号内:
A、验证同主族元素的金属性从上至下递增
B、验证同主族元素的非金属性从上至下递减
C、验证同周期元素的金属性从左至右递减
D、验证同周期元素的非金属性从左至右递增
实验1、比较钠、镁、铝分别与水反应的快慢 ______
实验2、溴化钠溶液中滴入氯水,碘化钠溶液中滴入溴水 ______
实验3、比较钾、钠分别与水反应的快慢 ______
实验4、在![]() 、
、![]() 溶液中逐滴加入NaOH溶液至过量,从而比较
溶液中逐滴加入NaOH溶液至过量,从而比较![]() 、
、![]() 的碱性 ______ .
的碱性 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学(或离子)方程式中,不能正确表达反应颜色变化的是
A.电解饱和食盐水产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.红热木炭遇浓硝酸产生红棕色气体:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D.向Ca(ClO)2溶液中通入少量SO2,出现白色沉淀SO2+Ca2++3ClO+H2O=CaSO4↓+2HClO+Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
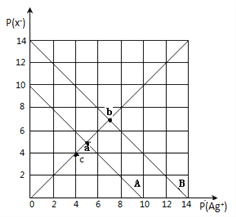
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),下列判断正确的是( )
Fe3O4(s)+4H2(g),下列判断正确的是( )
A.升高反应温度对反应限度无影响
B.改变H2的浓度对正反应速率无影响
C.保持体积不变,充入N2反应速率增大
D.保持压强不变,充入N2反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是_____________________________。
(2)火箭残骸中常出现红棕色气体,原因为:N2O4(g) ![]() 2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________。

若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ________mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )

A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com