
NaCl是一种化工原料,可以制备一系列物质(见图)。下列说法正确的是
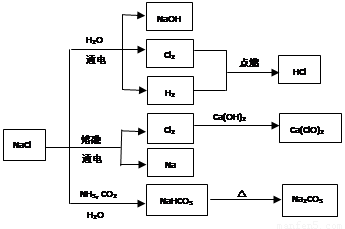
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.图中所示转化反应都是氧化还原反应
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
D
【解析】
试题分析:A项NaHCO3在水中的溶解度比Na2CO3的小,如在饱和碳酸钠溶液中通入二氧化碳会生成碳酸氢钠沉淀,故A错误;B项NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应都不是氧化还原反应,故B错误;C.常温下干燥的Cl2不与铁反应,但在点燃或加热条件下能反应;石灰乳与Cl2发生:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,只有Cl元素的化合价发生变化,Cl2既是氧化剂,又是还原剂,D正确。
考点:氯气的化学性质;氧化还原反应;探究碳酸钠与碳酸氢钠的性质.
点评:本题考查氯气的化学性质,题目难度中等,易错点为D,注意化合价的变化.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:江苏省仪征中学2010-2011学年高二上学期期末统考化学试题(选修) 题型:022
铬是一种用途广泛的化工原料,同时也是一种严重的污染物,且六价铬具有强烈的致癌作用.工业上为了处理含Cr2O![]() 的酸性废水,按下面的方法处理:往工业废水中加入适量的NaCl搅拌均匀;以铁为电极进行电解,从而使溶液的pH不断增大,废水由酸性转化为碱性,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,过滤回收沉淀,工业废水中铬的含量己低于排放标准.
的酸性废水,按下面的方法处理:往工业废水中加入适量的NaCl搅拌均匀;以铁为电极进行电解,从而使溶液的pH不断增大,废水由酸性转化为碱性,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,过滤回收沉淀,工业废水中铬的含量己低于排放标准.
试回答:
(1)加入适量的NaCl是为了________
(2)电极反应式:阳极________,阴极________
(3)由Cr2O![]() 变为Cr3十的离子方程式为________
变为Cr3十的离子方程式为________
(4)工业废水由酸性变碱性的原因为________
(5)能否改用石墨或铜电极________(填“能”或“不能”),原因为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com